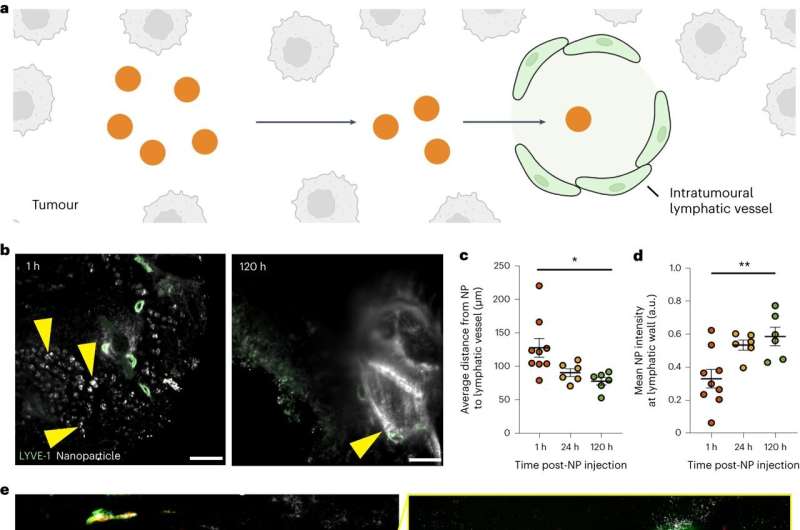
Nanodeeltjes worden afgevoerd naar intratumorale lymfevaten. Credit: Natuur materialen (2023). DOI: 10.1038/s41563-023-01630-0
Onderzoekers van de Universiteit van Toronto hebben een nieuwe theorie ontwikkeld om uit te leggen hoe nanodeeltjes de tumoren binnenkomen en verlaten die ze moeten behandelen, waardoor mogelijk het begrip van nanogeneeskunde tegen kanker wordt herschreven dat al bijna veertig jaar de leidraad is voor onderzoek.
Het Enhanced Permeability and Retention (EPR)-effect, een concept dat sinds het midden van de jaren tachtig grotendeels onbetwist is, stelt dat nanodeeltjes vanuit de bloedbaan een tumor binnendringen via gaten tussen de endotheelcellen die de bloedvaten bekleden – en vervolgens vast komen te zitten in de tumor als gevolg van disfunctionele lymfevaten.
“Het retentieaspect van de EPR-theorie hangt af van het feit dat de holte van het lymfevat te klein is om nanodeeltjes te laten ontsnappen, waardoor nanodeeltjes die kankerbestrijdende medicijnen bevatten, in de tumoren kunnen blijven”, zegt Matthew Nguyen, een Ph.D. student aan het Institute of Biomedical Engineering van de Faculteit Applied Science & Engineering en het Donnelly Center for Cellular and Biomolecular Research,
“Maar we ontdekten dat ongeveer 45 procent van de nanodeeltjes die zich ophopen in tumoren deze uiteindelijk zullen verlaten.”
Nguyen, lid van het laboratorium van professor Warren Chan, is de hoofdauteur van een nieuwe studie die onlangs in het tijdschrift is gepubliceerd Natuur materialen dat de al lang bestaande theorie uitdaagt. De bevindingen van de onderzoekers helpen verklaren waarom behandelingen op basis van het EPR-effect falen in klinische onderzoeken, voortbouwend op eerder onderzoek van het Chan-lab waaruit bleek dat minder dan één procent van de nanodeeltjes daadwerkelijk tumoren bereikt.
De onderzoekers ontdekten dat nanodeeltjes, in tegenstelling tot het EPR-effect, tumoren kunnen verlaten via hun lymfevaten. De uittredemethode voor een nanodeeltje hangt af van de grootte ervan, waarbij grotere (50-100 nanometer breed) waarschijnlijker de lymfevaten in de tumoren zullen verlaten, en kleinere (tot 15 nanometer breed) waarschijnlijker zullen verlaten via de lymfevaten eromheen. de tumoren.
In zeldzame gevallen zullen nanodeeltjes via de bloedvaten naar buiten komen.
Het verlaten van nanodeeltjes uit tumoren vindt plaats via ruimtes in de wanden van lymfevaten en transporteert blaasjes die ze over deze wanden dragen. De onderzoekers toonden aan dat nanodeeltjes na lymfedrainage opnieuw in de bloedbaan terechtkomen, en veronderstelden dat deze nanodeeltjes uiteindelijk naar de tumor zullen terugkeren voor een nieuwe kans om deze te behandelen.
Het weerleggen van het EPR-effect was geen eenvoudige opgave. Het Chan-lab heeft zes jaar lang gewerkt om te begrijpen waarom nanodeeltjes zich niet effectief ophopen in tumoren. Voorafgaand aan deze studie concentreerde het laboratorium zich in de eerste plaats op de manier waarop nanodeeltjes tumoren binnendringen. Door deze en andere onderzoeken ontwikkelde het laboratorium een concurrerende theorie over het EPR-effect, het Active Transport and Retention (ATR) -principe genoemd.
Nguyen merkte op dat het vakgebied van de nanogeneeskunde is geëvolueerd sinds de publicatie van het onderzoek naar de toegang tot nanodeeltjes in 2020. “We kregen meer tegenslag van andere onderzoekers op dat onderzoek vergeleken met dit onderzoek”, zei hij. “Mensen zijn gaan accepteren dat het EPR-effect gebrekkig is.”
Omdat bijna de helft van de opgehoopte nanodeeltjes tumoren verlaten, meestal via lymfevaten, zou toekomstig onderzoek dit probleem kunnen aanpakken door middel van behandelingen met nanodeeltjes die lymfedrainage voorkomen.
“We zijn blij dat we een beter begrip hebben van het proces van het afleveren van nanodeeltjestumoren”, zegt Chan. “De resultaten van deze fundamentele onderzoeken naar het binnenkomen en verlaten van nanodeeltjes zullen belangrijk zijn voor het ontwikkelen van nanodeeltjes om kanker te behandelen.”
De bevindingen van het onderzoek beloven, indien toegepast op het gebied van de nanogeneeskunde bij kanker, een nieuwe richting om ons begrip te verbeteren van hoe nanodeeltjes kunnen worden gebruikt om tumoren te behandelen.
“Proberen nanogeneeskunde tegen kanker naar de kliniek te vertalen is als werken met een zwarte doos: sommige medicijnen werken, andere niet, en het is moeilijk te begrijpen waarom”, zegt Gang Zheng, associate research director bij het Princess Margaret Cancer Center en een hoogleraar medische biofysica aan de Temerty Faculteit der Geneeskunde van U of T, die niet bij het onderzoek betrokken was.
“Chan’s toewijding aan een beter begrip van de mechanismen van de opname en uitgang van nanodeeltjes werpt licht op deze processen om onze vertaalinspanningen efficiënter en succesvoller te maken.”
Meer informatie:
Luan NM Nguyen et al, De uitgang van nanodeeltjes uit vaste tumoren, Natuurmaterialen (2023). DOI: 10.1038/s41563-023-01630-0
Tijdschriftinformatie:
Natuur materialen
Geleverd door de Universiteit van Toronto