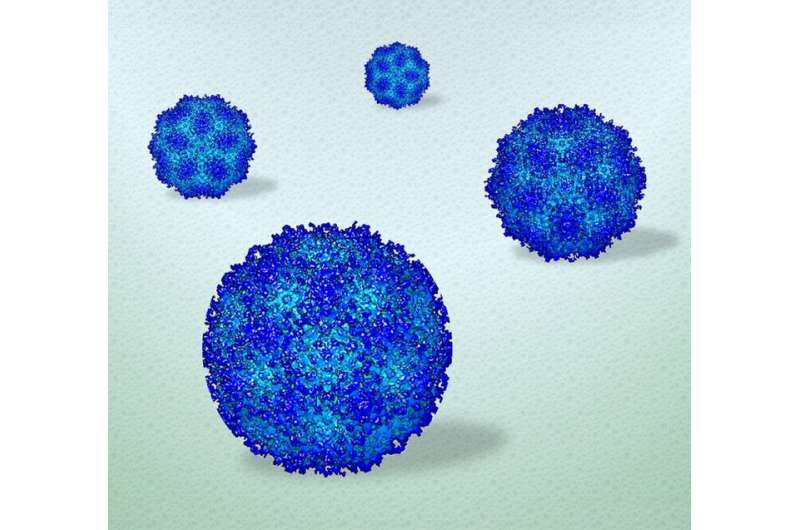
Onderzoekers van Penn State gebruikten elektronenmicroscopie om de eerste hoge resolutie weergave van virussen in een vloeibare omgeving te verkrijgen. De visualisatie kan informatie over de structuur en dynamiek van zachte materialen in realtime onthullen, terwijl de 3D-reconstructie (hier afgebeeld) de bevindingen kan bevestigen. Krediet: Deb Kelly, Penn State
Een vijver in de zomer kan meer vertellen over een vis dan een vijver in de winter. De vis die in ijzige omstandigheden leeft, blijft misschien stil genoeg om zijn schubben te bestuderen, maar om te begrijpen hoe de vis zwemt en zich gedraagt, moet hij vrij kunnen bewegen in drie dimensies. Hetzelfde geldt voor het analyseren hoe biologische items, zoals virussen, zich in het menselijk lichaam verplaatsen, volgens een onderzoeksteam onder leiding van Deb Kelly, Huck Chair in Molecular Biophysics en professor in biomedische technologie aan Penn State, die geavanceerde elektronenmicroscopie heeft gebruikt. (EM)-technologie om te zien hoe menselijke virussen zich in hoge resolutie verplaatsen in een bijna natuurlijke omgeving. De visualisatietechniek zou kunnen leiden tot een beter begrip van hoe vaccinkandidaten en behandelingen zich gedragen en functioneren als ze interageren met doelcellen, zei Kelly.
In een poging om de tools uit te breiden die wetenschappers hebben om de microscopische wereld te bestuderen, hebben onderzoekers live, 20 seconden durende films opgenomen van menselijke virussen die in vloeistof drijven met bijna atomaire details in een elektronenmicroscoop. Dezelfde mate van informatie, onmiddellijk beschikbaar als ze opnemen, kan tot 24 uur duren om te verkrijgen met behulp van traditionele statische beeldvormingsmethoden. Hun aanpak en resultaten zijn online beschikbaar gesteld op 24 juli in Geavanceerde materialen.
“De uitdaging bleef om biologische materialen te bekijken in dynamische systemen die hun authentieke prestaties in het lichaam weerspiegelen”, zegt Kelly, die ook leiding geeft aan het Penn State Center for Structural Oncology. “Onze resultaten laten nieuwe structuren en actieve inzichten zien van menselijke virussen in kleine hoeveelheden vloeistof – even groot als ademhalingsdruppeltjes die SARS-CoV-2 verspreiden.”
Cryogene elektronenmicroscopie (cryo-EM) wordt volgens Kelly de gouden standaard van het veld voor het observeren van monsters met of boven atomaire resolutie. De techniek omvat het flitsbevriezen van het monster en het focussen van een bundel elektronen er doorheen. De elektronen en de componenten van het monster werken op elkaar in, wat wordt opgevangen door detectoren die in het instrument zijn ingebed. Duizenden afbeeldingen kunnen worden verwerkt om te berekenen hoe het item er in 3D uitziet, maar er is meer nodig om volledig te begrijpen hoe het item functioneert in een meer natuurlijke omgeving.
“Hoewel cryo-EM ons veel informatie kan vertellen, produceert het nog steeds een statisch beeld”, zegt GM Jonaid, de eerste auteur van het artikel en een student in het Bioinformatics and Genomics Graduate Program in de Huck Institutes of the Life Sciences. Jonaid voert zijn promotieonderzoek uit in het laboratorium van Kelly. “Met verbeterde chips en een krachtige directe detector op de microscoop, kunnen we veel filmframes verzamelen om te zien hoe het monster in realtime werkt. We kunnen dingen zien hoe ze bestaan, niet alleen hoe we ze hebben voorbereid.”
De onderzoekers gebruikten adeno-associated virus (AAV) als modelsysteem om hun aanpak te demonstreren. AAV is een biologisch nanodeeltje dat kan worden gebruikt om vaccins of behandelingen rechtstreeks aan cellen te leveren. Het platform is gebaseerd op een gekaapt adenovirus, dat gemakkelijk verschillende soorten cellen kan binnendringen. Het gemak waarmee het in wisselwerking staat met cellen, maakt het een nuttige capsule om zijn ontworpen nuttige lading te vervoeren.
“AAV is een bekend vehikel voor gentherapie met huidige toepassingen die betrokken zijn bij de levering van geneesmiddelen en de ontwikkeling van vaccins voor COVID-19”, zei Kelly. “Dit modelsysteem is al goed bestudeerd, dus we kunnen het gebruiken om onze aanpak te valideren met als doel biologische rechten in vloeibare toestand te zien, zoals bewaard in het menselijk lichaam.”
De onderzoekers brachten minieme volumes vloeibare oplossing met AAV aan in de putjes van gespecialiseerde siliciumnitride-microchips, commercieel geleverd door Protochips Inc. Vervolgens plaatsten ze de microchip-assemblages in de EM om de virussen in actie te onderzoeken.
“De beelden zijn zeer vergelijkbaar met cryo-EM-gegevens, maar de voorbereiding was minder complex, minder technisch betrokken,” zei Jonaid. “Toen we de beelden hadden, snel genomen, zoals frames van een film, verwerkten we ze net als andere gegevens met een hoge resolutie.”
De resultaten waren video’s van AAV die in vloeistof bewogen, met subtiele veranderingen in het oppervlak van het deeltje, wat suggereert dat de fysieke eigenschappen van het deeltje veranderen terwijl het zijn omgeving verkent, zei Kelly. De resolutie was dichtbij drie tot vier Angstrom (een enkel atoom wordt gemeten als één Angstrom).
Toen ze eenmaal bewezen hadden dat de beeldvormende strategieën werkten, richtten de onderzoekers hun blik op een kleiner doelwit: antilichamen geproduceerd door COVID-19-patiënten.
“We hebben gezien hoe antilichamen in het serum van COVID-19-patiënten een interactie aangingen met de resterende SARS-CoV-2-deeltjes,” zei Kelly, en merkte op dat het vermogen om dergelijke interacties waar te nemen vooral nuttig zou zijn bij het beoordelen van de levensvatbaarheid van vaccinkandidaten voorafgaand aan klinische proeven.
Kelly en haar team zijn van plan om door te gaan met het onderzoeken van de moleculaire onderbouwing van SARS-CoV-2 en gastheerreceptor-eiwitten met behulp van vloeibare fase-EM, als aanvulling op de informatie die is verkregen uit cryo-EM-resultaten.
“Je hebt echt gegevens van beide technieken nodig om te begrijpen hoe virussen eruitzien en zich gedragen in het levende lichaam,” zei Kelly. “Het visualiseren van de dynamische beweging in een oplossing vormt een aanvulling op snapshots met een hoge resolutie om meer volledige informatie te onthullen.”
GM Jonaid et al, High-Resolution Imaging of Human Viruses in Liquid Droplets, Geavanceerde materialen (2021). DOI: 10.1002/adma.202103221
Geavanceerde materialen
Geleverd door Pennsylvania State University