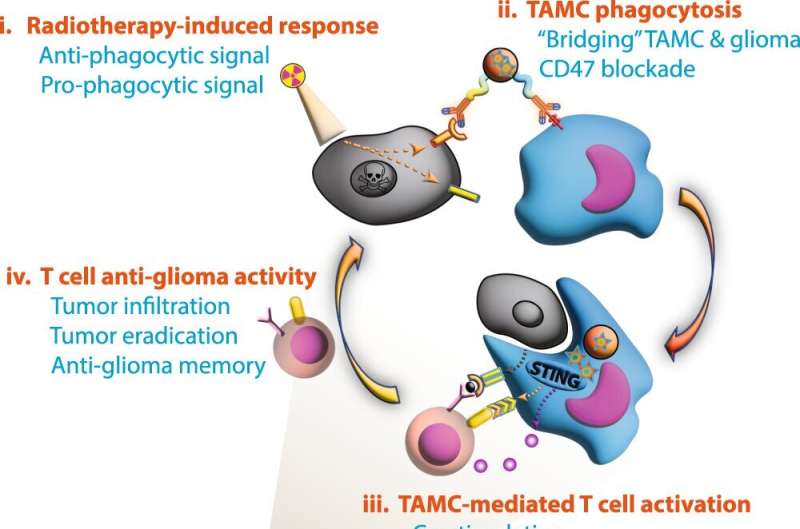
Schematische weergave van door B-LNP gemedieerde therapeutische kaping van TAMC’s om de antitumorimmuniteit te versterken en radiotherapie voor GBM te versterken. i, Radiotherapie (RT) induceert overexpressie van profagocytisch signaal calreticuline (CRT) en antifagocytisch molecuul CD47 in glioomcellen. ii, B-LNP’s werden ontworpen om TAMC’s en GBM te “overbruggen” via CD47 en PD-L1 dual-ligatie, beide checkpoint-moleculen te blokkeren en fagocytose van tumorcellen te bevorderen. iii, Naast het optreden als een engager, kapselen B-LNP’s ook STING-agonist in om type I interferon-responsen in TAMC’s te bevorderen, die infiltratie en activering van tumor-antigeen-specifieke T-cellen veroorzaken. iv, Geherprogrammeerde TAMC’s bevorderen door T-cellen gemedieerde antitumorresponsen, wat leidt tot duurzame tumoruitroeiing. TCR, T-celreceptor; MHC, belangrijk histocompatibiliteitscomplex. De figuur is gegenereerd met behulp van Adobe Illustrator. De muisillustratie is afkomstig van en aangepast van Scidraw.io. Credit: Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-37328-9
Onderzoekers van Northwestern Medicine hebben een nieuwe behandeling met nanodeeltjes voor glioblastoom ontwikkeld, volgens een studie gepubliceerd in Natuurcommunicatie.
Glioblastoma, het meest voorkomende type primaire hersenkanker, is volgens de National Brain Tumor Society een van de meest complexe, dodelijke en behandelingsresistente kankers. Het overlevingspercentage na vijf jaar voor glioblastoompatiënten schommelt rond de 7% en is al tientallen jaren onveranderd.
Vorige Northwestern Medicine onderzoek heeft aangetoond dat glioblastoomtumoren grote aantallen immunosuppressieve tumor-geassocieerde myeloïde cellen (TAMC’s) ophopen, wat het vermogen van het immuunsysteem om de tumor te bestrijden aantast en de effectiviteit van bestraling en chemotherapie vermindert.
“Immunosuppressie is een kenmerk van de micro-omgeving van de tumor”, zegt Peng Zhang, Ph.D., assistent-professor Neurologische Chirurgie en eerste auteur van de studie. “TAMC’s zijn een belangrijke motor van immunosuppressie en therapieresistentie. Omdat TAMC’s 30% tot 50% van de massa van hersentumoren uitmaken, is er een dringende behoefte om nieuwe therapeutische strategieën te ontwikkelen om die immunosuppressieve cellen in hersentumoren te richten en te moduleren.”
In de huidige studie richtten onderzoekers zich op gekweekte TAMC’s met een nanodeeltje dat ze ontwikkelden om dimeer amidobenzimidazool of diABZI af te geven, een recent ontwikkelde synthetische verbinding die zich richt op een eiwit dat bekend staat als stimulator van interferon-genen, of STING. Het nanodeeltje was ook geladen met antilichamen gericht op CD47 en PD-L1, twee immuuncontrolepunteiwitten die tot overexpressie worden gebracht in glioblastoomtumoren en TAMC’s na radiotherapie.
Volgens de studie produceerden de TAMC’s die de behandeling ontvingen aanzienlijk minder immunosuppressieve eiwitten en verhoogde immunostimulerende eiwitten.
Toen muizen met glioblastoma werden behandeld met nanodeeltjes, zagen wetenschappers een piek in het aantal geactiveerde T-cellen, die meestal verantwoordelijk zijn voor het opzetten van een immuunrespons tegen de tumor, maar grotendeels afwezig zijn in hersentumoren. De T-cellen in de behandelde muizen infiltreerden in grotere aantallen de tumor en verlengden de levensduur van de muizen, aldus de studie.
Bovendien werden tumoren bij bijna 70% van de dieren uitgeroeid na de behandeling met nanodeeltjes en bestralingstherapie, een standaardbehandeling voor glioblastoom.
“Het overwinnen van immunosuppressie van tumoren is de sleutel tot het ontwerpen van effectieve immunotherapeutische strategieën”, aldus Maciej Lesniak, MD, voorzitter en de Michael J. Marchese hoogleraar neurochirurgie en senior auteur van de studie. “Deze benadering opent de weg voor het moduleren van de micro-omgeving van de tumor op een zodanige manier dat het potentieel van immunotherapie wordt vergroot.”
Onderzoekers repliceerden vervolgens het experiment met behulp van tumor- en bloedmonsters van glioblastoompatiënten en observeerden opnieuw de opnieuw geprogrammeerde TAMC’s en geactiveerde antitumor-T-cellen.
De resultaten suggereren dat de behandeling met nanodeeltjes een effectieve manier zou kunnen zijn om de bestaande zorg aan te vullen en de immuunrespons bij glioblastoom te stimuleren, zei Lesniak.
Lesniak, Zhang en hun medewerkers hopen de behandeling met nanodeeltjes naar klinische proeven te brengen, zei Zhang.
“We willen ook meer inzicht krijgen in hoe de immuunrespons van de gastheer zou kunnen bijdragen aan de therapie-efficiëntie of therapieresistentie van die tumoren,” zei Zhang. “We willen ook het immuunmetabolisme en de bio-informatica opnemen in ons multidisciplinair onderzoek, zodat we grondig werk kunnen leveren met betrekking tot het ontwerp van de volgende generatie therapieën tegen hersentumoren.”
Meer informatie:
Peng Zhang et al, STING-agonist-geladen, CD47 / PD-L1-gerichte nanodeeltjes versterken antitumorimmuniteit en radiotherapie voor glioblastoom, Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-37328-9
Tijdschrift informatie:
Natuurcommunicatie
Geleverd door Northwestern University Feinberg School of Medicine