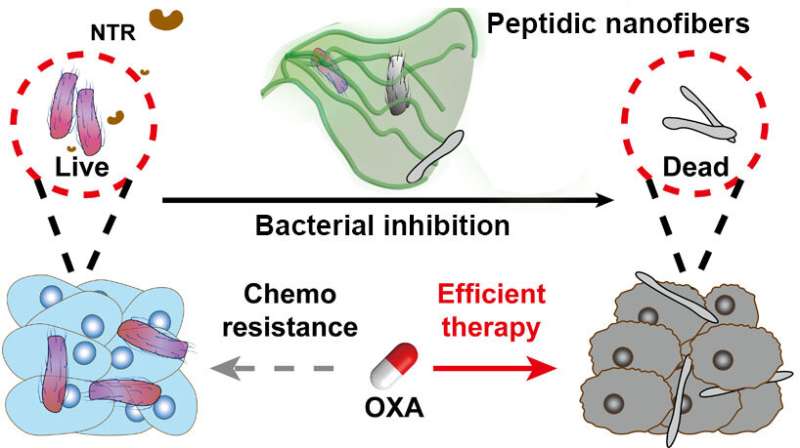
Schema’s die de NTR-geïnstrueerde peptidische nanovezels tonen met antibacteriële activiteit om bacteriegroei te remmen en resulteren in efficiënte antikankertherapie. Krediet: Gao Yuan et al
Colorectale kanker (CRC) is naar voren gekomen als een vaak gediagnosticeerde ziekte. Geavanceerde CRC’s zijn zeer heterogeen en ontwijken vaak behandelingen, waardoor resistentie tegen geneesmiddelen wordt opgebouwd en terugkeren.
Fusobacterium nucleatum (F. nucleatum) is een van de meest voorkomende bacteriesoorten in weefsels van colorectale kanker. De toename van F. nucleatum bevordert en vestigt niet alleen CRC, maar induceert ook metastase en resistentie tegen geneesmiddelen. Het richten op dergelijke kanker-geassocieerde micro-organismen zou een nieuwe methode kunnen bieden om resistentie tegen geneesmiddelen af te schaffen en slechte chemotherapie-resultaten te verbeteren.
In een studie gepubliceerd in Wetenschappelijke vooruitgangGao Yuan’s groep van het National Center for Nanoscience and Technology (NCNST) van de Chinese Academie van Wetenschappen (CAS) leverde een antibioticavrije strategie om specifieke bacteriestammen te remmen voor verbeterde CRC-behandeling door een door nitroreductase (NTR) geïnstrueerd supramoleculaire zelf -assemblagesysteem dat F. nucleatum kan remmen en CRC kan sensibiliseren voor chemotherapie.
De onderzoekers synthetiseerden een atypisch NTR-responsief motief door een extra hydrofiele carboxylgroep aan de nitrobenzeengroep toe te voegen. De conjugatie van het op NTR reagerende motief aan een geschikte peptidesequentie leverde een assemblagevoorloper op. De voorlopers ondergingen NTR-gekatalyseerde transformatie en vormden geordende nanovezels, zowel in vitro als in levende systemen.
Deze nanovezels vertoonden eerder dan de individuele moleculen antibacteriële activiteit tegen F. nucleatum. De lokale introductie van NTR-geïnstrueerde assemblages verlichtte het door bacteriën geïnduceerde oxaliplatine (OXA) resistentie-effect aanzienlijk en remde uiteindelijk de tumorgroei op efficiënte wijze.
Vervolgens bevestigden de onderzoekers dat de remming van F. nucleatum bijdroeg aan de verbeterde resultaten van chemotherapie. Ze verklaarden dat supramoleculaire zelfassemblage zou kunnen dienen als een abiotische strategie om interacties tussen bacteriën en zoogdiercellen te onderbreken en CRC-therapie te verbeteren.
“Een dergelijke strategie zou van toepassing moeten zijn om andere kankertherapieën te verbeteren als de tumoren het risico op microbiële infecties dragen”, zei Gao. Als we E. coli-geassocieerde geneesmiddelresistente alvleesklierkanker als voorbeeld nemen, zal E. coli in een dergelijk model het antikankergeneesmiddel Gemcitabine in zijn inactieve vorm metaboliseren, wat resulteert in het mislukken van chemotherapie tegen alvleesklierkanker.
Meer informatie:
Jiali Chen et al, Nitroreductase-geïnstrueerde supramoleculaire assemblages voor microbioomregulatie om behandelingen van colorectale kanker te verbeteren, Wetenschappelijke vooruitgang (2022). DOI: 10.1126/sciadv.add2789
Journaal informatie:
Wetenschappelijke vooruitgang
Geleverd door de Chinese Academie van Wetenschappen