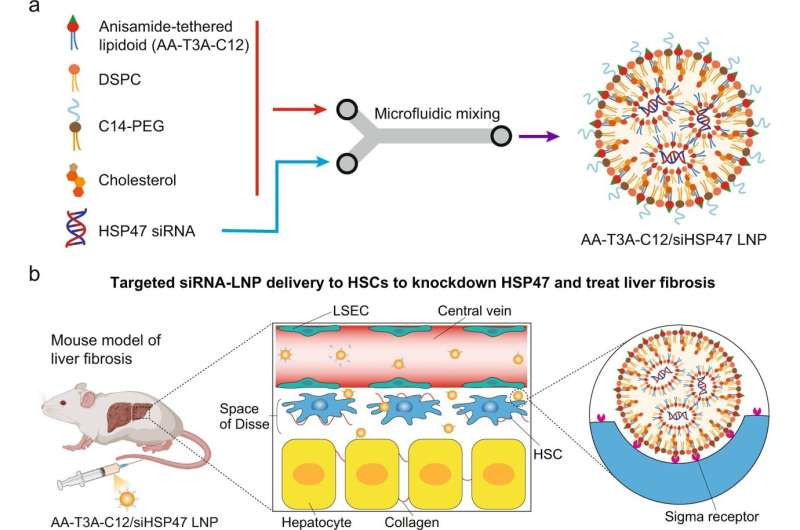
Bereiding en toepassing van ligandgebonden lipidoïde nanodeeltjes voor gerichte siRNA-afgifte aan HSC’s om leverfibrose te behandelen. a Formulering van AA-T3A-C12/siHSP47 LNP via microfluïdische menging. De ethanollipide-oplossing die anisamide-gebonden lipidoïde (AA-T3A-C12), fosfolipide (DSPC), PEG-lipide (C14-PEG) en cholesterol bevat, wordt snel gemengd met een zure waterige oplossing die HSP47-siRNA bevat in een microfluïdisch apparaat om te formuleren AA-T3A-C12/siHSP47 LNP. b Schema van gerichte AA-T3A-C12 / siHSP47 LNP-afgifte aan geactiveerde HSC’s om HSP47 uit te schakelen en leverfibrose te behandelen. HSC’s bevinden zich in de ruimte van Disse, een gebied tussen LSEC’s en hepatocyten. Na snel PEG in omloop te hebben gebracht, legt de LNP multivalente anisamideliganden op het oppervlak bloot die sterk kunnen binden met sigma-receptoren die tot overexpressie worden gebracht op geactiveerde HSC’s om cellulaire opname te mediëren. b is gemaakt met BioRender.com. Credit: Natuurcommunicatie (2023). DOI: 10.1038/s41467-022-35637-z
Sinds het succes van het COVID-19-vaccin krijgen RNA-therapieën steeds meer belangstelling in de biotechwereld. Deze therapieën werken samen met uw lichaam om de genetische wortel van ziekten en infecties aan te pakken, een veelbelovende alternatieve behandelmethode voor die van traditionele farmaceutische medicijnen.
Lipidenanodeeltjes (LNP’s) worden al tientallen jaren met succes gebruikt bij de toediening van medicijnen. Door de FDA goedgekeurde therapieën gebruiken ze als voertuigen voor het afleveren van boodschapper-RNA (mRNA), dat de cel ertoe aanzet nieuwe eiwitten te maken, en klein interfererend RNA (siRNA), dat de cel instrueert om de expressie van bepaalde eiwitten tot zwijgen te brengen of te remmen.
De grootste uitdaging bij het ontwikkelen van een succesvolle RNA-therapie is de gerichte toediening ervan. Onderzoek confronteert nu de huidige beperkingen van LNP’s, waardoor veel ziekten geen effectieve RNA-therapie hebben.
Leverfibrose treedt op wanneer de lever herhaaldelijk wordt beschadigd en het genezingsproces resulteert in de ophoping van littekenweefsel, waardoor een gezonde leverfunctie wordt belemmerd. Het is een chronische ziekte die wordt gekenmerkt door de opbouw van overmatige collageenrijke extracellulaire matrix (ECM). Leverfibrose is een uitdaging gebleven om te behandelen met behulp van RNA-therapieën vanwege een gebrek aan toedieningssystemen voor het richten van geactiveerde leverfibroblasten. Zowel de solide fibroblaststructuur als het gebrek aan specificiteit of affiniteit om zich op deze fibroblasten te richten, heeft de huidige LNP’s verhinderd om geactiveerde lever-residente fibroblasten binnen te gaan, en daarom zijn ze niet in staat om RNA-therapeutica af te leveren.
Om dit probleem aan te pakken en te helpen bij het bieden van een behandeling voor de miljoenen mensen die aan deze chronische ziekte lijden, hebben Michael Mitchell, J. Peter en Geri Skirkanich, assistent-professor Innovatie bij de afdeling Bioengineering, en postdoctorale fellows Xuexiang Han en Ningqiang Gong, gevonden een nieuwe manier om ligand-gebonden LNP’s te synthetiseren, waardoor hun selectiviteit toeneemt en ze zich kunnen richten op leverfibroblasten.
Lulu Xue, Margaret Billingsley, Rakan El-Mayta, Sarah J. Shepherd, Mohamad-Gabriel Alameh en Drew Weissman, Roberts Family Professor in Vaccine Research en directeur van het Penn Institute for RNA Innovation aan de Perelman School of Medicine, hebben hier ook aan bijgedragen werk.
Hun studie, gepubliceerd in Natuurcommunicatielaat zien hoe een ligand met een klein molecuul dat is opgenomen in de synthese van het ioniseerbare lipide, een sleutelcomponent van de LNP, een affiniteit creëert met de notoir moeilijk te richten geactiveerde fibroblasten in de lever die verantwoordelijk zijn voor de opbouw van collageen.
De opbouw van collageen gaat gepaard met een verhoogde expressie van Heat Shock Protein 47 (HSP47), het eiwit dat de biogenese en secretie van collageen stimuleert. Overexpressie van HSP47 en verhoogde collageenbiogenese gaan uiteindelijk over in fibrose.
Zodra hun LNP’s aankomen en de doelcel binnengaan, wordt siRNA vrijgegeven, wat de expressie van HSP47 tot zwijgen brengt, de productie van collageen remt en fibrose stopt. De behandeling, waarvan is aangetoond dat deze succesvol is bij muizen, is een veelbelovende behandeling voor leverfibrose bij mensen.
Deze nieuwe benadering van ioniseerbare lipidesynthese is de sleutel tot het openen van veel meer deuren voor RNA-therapie om diverse ziekten te behandelen.
“Om LNP’s selectief genoeg te maken om zich te richten op hepatische stellaatcellen, die cellen die fibrose veroorzaken, hebben we een anisamideligand, een molecuul dat een hoge affiniteit heeft voor de receptor op deze stellaatcellen, opgenomen in de structuur van het ioniseerbare lipide”, zegt Mitchell. “In wezen hebben we een slot-en-sleutelmechanisme gemaakt om de levering aan deze moeilijk bereikbare cellen te richten en te ontgrendelen.”
Het syntheseproces is door Han en collega’s ontwikkeld als een “éénpot, tweestapsproces”. Om een bibliotheek van ioniseerbare lipiden te creëren, bracht het team eerst een anisamideligand (AA)-precursor en verschillende aminokernen samen. Vervolgens voegden ze de hydrofobe staart toe om AA-gebonden ioniseerbare lipiden te creëren. Anisamide werd gekozen als ligand vanwege zijn neutrale en stabiele aard en zijn affiniteit voor de tot overexpressie gebrachte sigma-receptoren op stellaatcellen. Nadat de bibliotheek van AA-gebonden LNP’s was gemaakt, analyseerde het team hun mogelijkheden om zich te richten op en therapie aan cellen te leveren door middel van een selectieproces van twee ronden.
“We moesten een specifieke AA-tethered LNP vinden die zowel krachtig als selectief was”, zegt Han. “De eerste ronde van het selectieproces werd gedaan door te onderzoeken hoe goed onze LNP’s groen fluorescentie-eiwit (GFP) in fibroblasten konden uitschakelen om de potentie te meten. GFP levert geweldig visueel bewijs voor hoe therapeutisch RNA genexpressie in realtime uitschakelt.”
“In de tweede ronde hebben we het selectieve vermogen van de krachtige LNP getest”, zegt Han. “We deden dit door de sigma-receptor te blokkeren om te begrijpen hoe belangrijk de specifieke AA-ligandgroep was in het vermogen van de LNP om in doelcellen te komen. Het is niet verwonderlijk dat we hebben aangetoond dat de AA-groep significant was; na de sigma-receptorblokkade verloren we het slot -en-sleutel mechanisme en de AA-gebonden LNP zou de doelcel niet binnengaan.”
Het team identificeerde AA-T3A-C12 als zowel een krachtige als selectieve LNP die therapeutisch siRNA draagt, in staat om 65% knockdown van HSP47-expressie bij muizen te bereiken en het herstel van beschadigd leverweefsel te verbeteren. De resultaten van de studie concluderen dat de AA-T3A-C12 LNP beter presteert dan de MC3 LNP, een klinisch gebruikte niet-virale vector die door de FDA is goedgekeurd voor gebruik bij lever- of levercel-RNA-therapie.
Deze nieuwe ligandgebonden LNP biedt een vorm van behandeling voor leverfibrose en de synthesemethode biedt een manier om LNP’s aan te passen aan andere voorheen moeilijk te bereiken cellen en weefsels in het lichaam.
“Het potentieel van LNP’s is enorm”, zegt Han. “We maken LNP’s slimmer en efficiënter.”
“We zijn verheugd dat we een potentiële behandeling hebben geproduceerd die de genetische wortel van deze leverziekte aanpakt”, zegt Mitchell. “En omdat dit LNP-aflevermiddel werkt in fibrotische cellen van de lever, kan het leiden tot de ontwikkeling van een behandeling voor andere soorten fibrose in het lichaam, zoals fibrose die ontstaat in de longen of in tumoren.”
“Afgezien van wat we in de lever hebben onderzocht, kan deze methode voor het maken van LNP’s worden gebruikt om de afgifte voor therapieën aan andere celtypen te ontgrendelen”, voegt hij eraan toe. “We zouden mogelijk cellen in de hersenen, longen of het hart kunnen targeten door specifieke targeting-liganden in de ioniseerbare lipidestructuur te installeren. Er zijn veel wegen vanaf hier en we zijn verheugd om dit onderzoek in nieuwe richtingen te blijven duwen.”
Meer informatie:
Xuexiang Han et al, Ligand-gebonden lipidenanodeeltjes voor gerichte RNA-afgifte om leverfibrose te behandelen, Natuurcommunicatie (2023). DOI: 10.1038/s41467-022-35637-z
Tijdschrift informatie:
Natuurcommunicatie
Aangeboden door de Universiteit van Pennsylvania