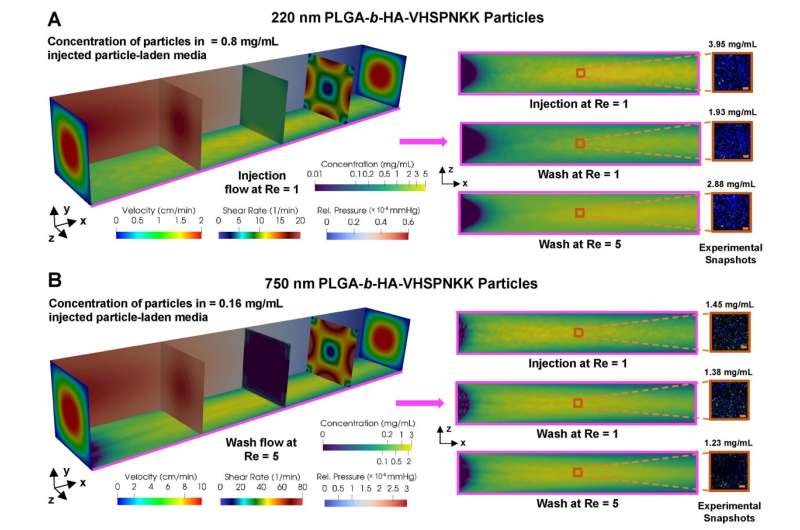
Kamerstroomsimulatie voor deeltjeshechting voor 220 nm deeltjes (boven) en voor 750 nm deeltjes (onder). Grotere deeltjes vertonen een grotere retentie na de wasfase dan kleinere deeltjes. Credit: The Grainger College of Engineering aan de University of Illinois Urbana-Champaign
Ondanks dat nanodeeltjes de laatste jaren een slechte naam hebben gekregen in de reguliere media, worden ze al tientallen jaren succesvol gebruikt in gerichte medicijnafgiftesystemen. Medicijnmoleculen kunnen worden ingekapseld in biologisch afbreekbare nanodeeltjes om te worden afgeleverd aan specifieke cellen of zieke weefsels. De dynamiek van de bloedstroom kan echter een aanzienlijke invloed hebben op het vermogen van het nanodeeltje om zich te binden aan de doellocatie en lang genoeg te blijven kleven om het medicijn vrij te geven.
Geïnspireerd door civiele, mechanische, elektrische en chemische technologie hebben de Urbana-Champaign-professoren van de Universiteit van Illinois, Arif Masud en Hyunjoon Kong, een nieuw wiskundig model ontwikkeld en getest om de effecten van de bloedstroom op de adhesie en retentie van medicijndragers op nanodeeltjes nauwkeurig te simuleren. Het model kwam nauw overeen met in-vitro-experimenten, wat de impact aantoont die modelgebaseerde simulaties kunnen hebben op de optimalisatie van nanocarriers. Dit zal op zijn beurt het ontwerp van geneesmiddelen en de patiëntspecifieke behandeling versnellen.
De resultaten van dit onderzoek werden onlangs gepubliceerd in de Handelingen van de Nationale Academie van Wetenschappen.
Hoewel behandelingen met therapeutische medicijnen die via de bloedbaan aan zieke weefsels worden toegediend effectief zijn, is het nog steeds onduidelijk in hoeverre de dynamiek van de bloedstroom de retentie van nanodeeltjes-medicijndragers op doellocaties kan beïnvloeden, wat enorm kan verschillen tussen diermodellen en mensen. Er zijn talloze factoren die de bloedstroomsnelheid van een individu kunnen beïnvloeden, waaronder hun leeftijd, geslacht en mate van fysieke activiteit, wat het een zeer complex probleem maakt.
“Neem een hoogbouw: er zijn veel pijpen en veel hoeken, maar water bereikt elk punt van het gebouw”, legt Masud uit. “Op dezelfde manier hebben we een soortgelijk netwerk in ons lichaam, maar de ‘pijpen’ bewegen en buigen de hele tijd. De belangrijkste bijdrage van dit werk is de ontwikkeling van een techniek die kan worden gebruikt voor het optimaliseren van de medicijnafgifte door de stroomsnelheid uit te zoeken, transport naar een specifiek punt en bevestiging van de nanodrager aan die plek.”
Kong voegt toe: “Er zijn studies uitgevoerd met muismodellen en in-vitro weefselmodellen. Wij hebben nanodeeltjes echter vooral ontworpen door middel van trial and error. Dit is het eerste soort demonstratie waarbij er sprake is van een systematischer, robuuster ontwerp van nanodeeltjes, onder begeleiding van de natuurkunde.”
Masud en zijn team werkten al een tijdje aan een wiskundig model voor de bloedstroom, maar het model en de experimentele gegevens leverden niet dezelfde resultaten op omdat ze ervan uitgingen dat de bloedstroom plaatsvindt in een geïdealiseerde omgeving. Ze beseften dat ze nieuwe ideeën moesten inbrengen om passende resultaten te krijgen.
Ten eerste is het oppervlak van de endotheelcellen – de enkele cellaag die de bloedvaten bekleedt – niet zo glad als gepolijst glas op microschaal. Om deze ruwheid aan te passen, hebben ze een oneffenheidsmodel uit de machinebouw ingebouwd, dat rekening houdt met vervorming wanneer materialen die in contact komen, onderhevig zijn aan kracht. Een dergelijk model wordt doorgaans gebruikt voor metalen, maar de onderzoekers hebben het aangepast voor cellulaire materialen.
Om nanodragers van de bulkbloedstroom naar het endotheeloppervlak te trekken om vervolgens het zieke weefsel te penetreren, gebruikten ze het concept van Lorentz-krachten uit de elektrotechniek. In plaats van een magnetische aantrekkingskracht, maakten ze gebruik van proteïne-proteïne-aantrekking door de nanodrager te coaten met hetzelfde proteïne dat door het zieke weefsel op de doellocatie werd uitgescheiden.
Ten slotte haalde het team van Masud inspiratie uit een oud civieltechnisch artikel waarin onderzoek werd gedaan naar de oppervlaktevorming en de afzetting van zanddeeltjes op de rivierbedding van de Theems. Ze gebruikten dit om een model te maken voor de deeltjesstroom in het grenslaaggebied.
“We haalden deze nieuwe ideeën uit heel verschillende vakgebieden binnen de techniek en het model begon te werken”, aldus Masud.
Het team van Masud ontwikkelde eerst het wiskundige model en om het vervolgens te verfijnen, voerde de groep van Kong experimenten uit in zorgvuldig ontworpen biokamers met laagjes endotheelcellen. Nanodeeltjes werden geïnjecteerd met een snelheid die het arteriële systeem repliceerde en vervolgens gespoeld tijdens een wascyclus om de concentratie van de resterende deeltjes te bepalen. Op basis van de resultaten werd het model verder geoptimaliseerd totdat simulaties en experimenten vergelijkbare resultaten opleverden.
“Het model is heel algemeen en kan worden toegepast op elk soort ziekte, verschillende vormen van nanodeeltjes en verschillende medicijnen,” legt Masud uit. “Het mooie van het computermodel is dat we medicijnontwerp en -behandeling in een digitale omgeving kunnen optimaliseren en het kunnen toepassen op een specifieke patiënt.”
Met behulp van geavanceerde beeldvormingstechnologie zoals MRI en CT kan de arteriële structuur van een patiënt worden nagebootst, terwijl ook de specifieke bloeddruk, bloedsamenstelling en viscositeit worden meegenomen. “We kunnen een digitale tweeling van een levend mens creëren om het medicijn voor die patiënt te optimaliseren”, zegt Masud.
Dit kan de tijd om een geoptimaliseerd behandelprotocol voor een bepaalde patiënt te vinden, aanzienlijk verkorten. Dit kan maanden, zelfs een jaar of langer duren. Met dit model kunnen simulaties op supercomputers worden uitgevoerd in slechts 24 tot 48 uur.
Verder waren Masud en Kong ook in staat om het effect van de nanodeeltjesgrootte te simuleren en ontdekten dat grotere deeltjes daadwerkelijk beter presteerden bij adhesie en retentie aan de endotheliale laag. Onderzoekers hebben zich over het algemeen geconcentreerd op kleinere deeltjes, zodat ze door kleinere haarvaten konden gaan en de doellocatie konden bereiken. “Maar een van de interessante bevindingen uit de simulatie en experimenten was een aanzienlijk verlies aan deeltjes als gevolg van externe stroming voor nanodeeltjes met een kleine diameter”, zegt Kong.
De simulatie toonde aan dat 200 nanometer deeltjes problemen hadden met loslaten en weggespoeld zouden worden met externe stroming. Door de diameter te vergroten tot 1000 nanometer werden de nanodeeltjes te groot voor transport. Maar 700 nanometer was de “Goldilocks”-grootte en optimaliseerde de hechting van deeltjes aan de vaatwand.
Deze interessante bevinding benadrukt het belang van simulatie bij het ontwerpen en afleveren van geneesmiddelen. Kong zegt: “Het gebruik van een muismodel lijkt niet altijd goed te werken voor mensen. We hebben heel verschillende fysiologische eigenschappen op het gebied van de bloedstroom. Over het algemeen kan simulatie een zeer krachtig hulpmiddel zijn.”
Meer informatie:
Shoaib A. Goraya et al., Modellering van spatiotemporele dynamiek van met ligand gecoate deeltjesstroom in gerichte medicijnafgifteprocessen, Handelingen van de Nationale Academie van Wetenschappen (2024). DOI: 10.1073/pnas.2314533121
Informatie over het tijdschrift:
Proceedings van de Nationale Academie van Wetenschappen
Aangeboden door University of Illinois Grainger College of Engineering