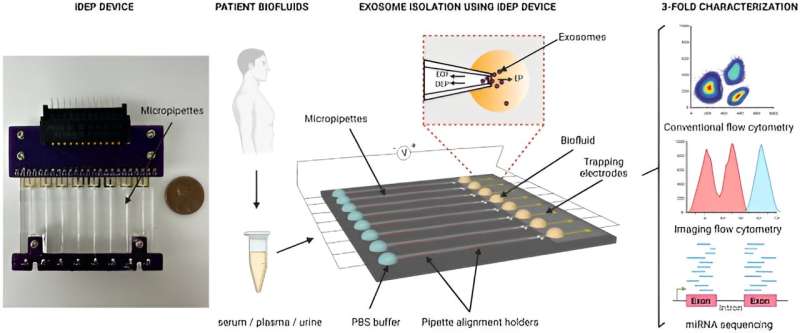
Apparaatindeling en grafische schets van experimentele stroom. Kleine extracellulaire blaasjes (sEV’s) werden gelijktijdig uit menselijke biovloeistoffen geëxtraheerd met behulp van het op isolator gebaseerde diëlektroforetische (iDEP) apparaat, waarbij een vangzone werd gecreëerd aan het uiteinde van micropipetten door de diëlektroforetische (DEP) kracht in evenwicht te brengen met twee elektrokinetische krachten, waaronder elektro-osmose. (EOF) en elektroforese (EP). sEVs-isolaten werden uitgebreid gekarakteriseerd met behulp van flowcytometrie, ImageStreamx en microRNA (miRNA) sequencing. Credit: Wetenschappelijke rapportendoi: 10.1038/s41598-023-45409-4
Alle cellen scheiden nanoschaal uit extracellulaire blaasjes natuurlijk als door lipiden dubbellaags begrensde deeltjes. Daarom zijn het geldige biomarkers om een verscheidenheid aan ziekten te identificeren.
Het is belangrijk om kleine extracellulaire blaasjes efficiënt te isoleren met behoud van de opbrengst en zuiverheid om hun potentieel in diagnostische, prognostische en therapeutische toepassingen te onderzoeken.
Conventionele isolatiemethoden hebben tekortkomingen, waaronder een lage zuiverheid en opbrengst, langdurige extractieprocedures, gespecialiseerde apparatuur en hoge kosten.
In een onderzoek gepubliceerd in Wetenschappelijke rapportenManju Sharma en een team van wetenschappers in biomedische technologie aan de Universiteit van Cincinnati, Ohio, VS, ontwikkelden een nieuw op isolator gebaseerd diëlektroforetisch apparaat om snel kleine extracellulaire blaasjes te isoleren uit biovloeistoffen en celcultuurmedia, op basis van hun diëlektrische eigenschappen.
De wetenschappers karakteriseerden met behulp van het instrument de kleine extracellulaire blaasjes geïsoleerd uit de biovloeistoffen van kankerpatiënten en voerden een drievoudige karakterisering uit met conventionele flowcytometriegeavanceerde beeldvormende flowcytometrie, en microRNA-sequencing om een hoge opbrengst aan zuivere extracellulaire blaasjes te verkrijgen. Het platform is efficiënt in het snel isoleren van biomarkers en het behouden van de biomoleculaire integriteit van de blaasjes.
In membraan ingekapselde biologische vaten
Biologisch gezien zijn kleine extracellulaire blaasjes membraan-ingekapselde biologische vaten die worden aangetroffen in biovloeistoffen zoals bloedurine, speekselsperma, moedermelk En hersenvocht; vrijgegeven door cellen in de extracellulaire ruimte.
Dergelijke blaasjes op nanoschaal kunnen hun biomoleculaire lading horizontaal overbrengen om te functioneren als intercellulaire signaalvectoren. Dergelijke extracellulaire blaasjes zorgen vanwege hun hoge mate van gevoeligheid en specificiteit uitstekende stabiliteit. Hun vroege detectie in vloeibare biopsieën kan de detectie van kankerinfecties en neurodegeneratieve, en stofwisselingsziekten.
De isolatie van de blaasjes is echter een uitdaging vanwege hun nanoschaalgrootte fysisch-chemische eigenschappen. Isolatiemethoden zijn doorgaans afhankelijk van de eigenschappen van de extracellulaire blaasjes, en hoewel dergelijke apparaten veelbelovende eigenschappen hebben, zijn de fabricagekosten, de verdunning van het monster en de gevoeligheid voor verstopping inherente uitdagingen.
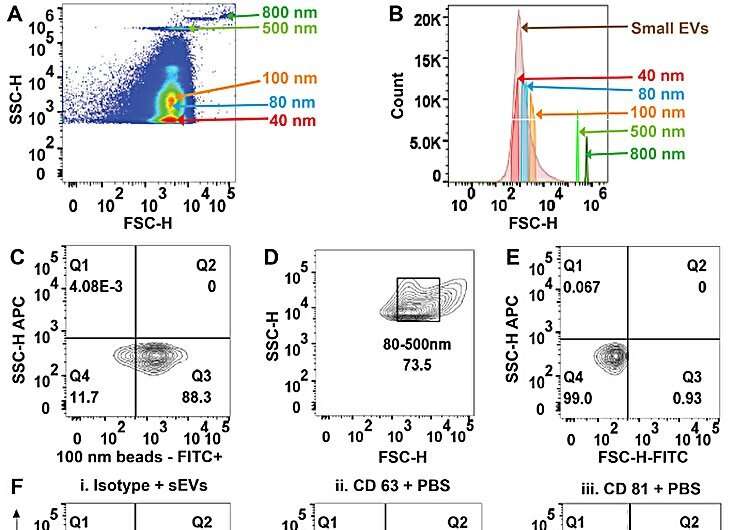
(A) FSC-H versus SSC-H van PS-COOH-kralenanalyse op flowcytometrie met hoge resolutie vertegenwoordigt de resolutie van de korrelgrootte in PS-COOH-mix. (B) Histogram dat verschillende groottes van PS-COOH-kralen en van serum afgeleide kleine extracellulaire blaasjes (sEV’s) illustreert. (C) Representatieve plots van PS-COOH-100 nm kralen fluorescentie-FITC. (D) Representatieve FSC-H versus SSC-H van sEVs-isolaten uit menselijk plasma. (E) Representatieve FSC-H versus SSC-H van ongekleurde sEV’s die gating demonstreren. (F) Representatieve plots als negatieve controles i. Isotype-gekleurde sEV’s. ii. CD63-antilichaam in PBS en iii. CD81-antilichaam in PBS. (G) Representatieve puntplots van sEV’s gekleurd voor CD63 van i. serumii. plasma en iii. urine. (H) Representatieve plots van sEV’s gekleurd voor CD81 van i. serumii. plasma en iii. urine. Credit: Wetenschappelijke rapportendoi: 10.1038/s41598-023-45409-4
Als reactie daarop ontwikkelden Sharma en collega’s een klasse nieuwe, op isolator gebaseerde diëlektroforetische benaderingen met micropilaren in microfluïdische kanalen om nanodeeltjes snel te overspoelen op basis van hun grootte en unieke diëlektrische eigenschappen.
Werkingsmechanisme
Het apparaat beschikte over een reeks micropipetten die in staat zijn nanodeeltjes te isoleren uit kleine monstervolumes door een aanzienlijk laag elektrisch veld aan te leggen over het hele oppervlak. lengte van de pipetten. De architectuur van de poriëngeometrie maakte de isolatie mogelijk van extracellulaire blaasjes uit kleine monstervolumes van geconditioneerde celkweekmedia, en biovloeistoffen van gezonde donoren.
In dit werk isoleerden Sharma en team de biovloeistoffen van kankerpatiënten, waaronder serum, plasma en urine, gevolgd door multiparametrische karakterisering via flowcytometrie en de volgende generatie miRNA-sequencing.
-
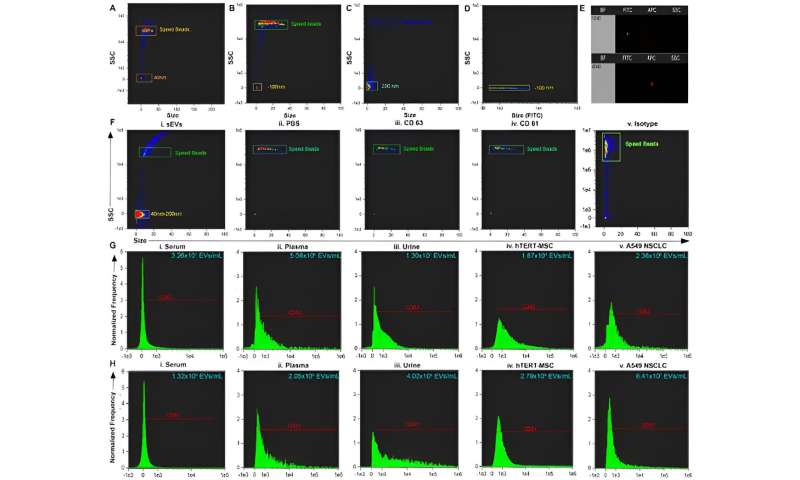
(A – C) Grootte versus SSC van kralen en kralen voor kalibratiesnelheid. (D) Grootte versus FITC ter illustratie van de locatie aan de zijkant die positief is voor fluorescerende kralen. (E) Representatieve puntengrafiek van FITC versus spreidingsintensiteit (boven) en APC versus spreidingsintensiteit (onder). (F) Representatieve grootte versus SSC-plot van i. kleine extracellulaire blaasjes (sEV’s) gezuiverd uit biovloeistof en negatieve controles: ii. PBS iii. antilichaam CD63 iv. antilichaam CD81 en v. Isotype. (G) Representatief histogram van CD63+ sEV’s uit i. serum, ii. plasma, iii. urine en positieve controles: iv. hTERT-geïmmortaliseerde mesenchymale stamcel (MSC) sEV’s, en v. A549 niet-kleincellig longcarcinoom (NSCLC)-afgeleide sEV’s. (H) Representatief histogram van CD81+ sEV’s uit i. serum, ii. plasma, iii. urine en positieve controles iv. hTERT-geïmmortaliseerde MSC sEV’s, en v. A549 NSCLC sEV’s. Credit: Wetenschappelijke rapportendoi: 10.1038/s41598-023-45409-4
-
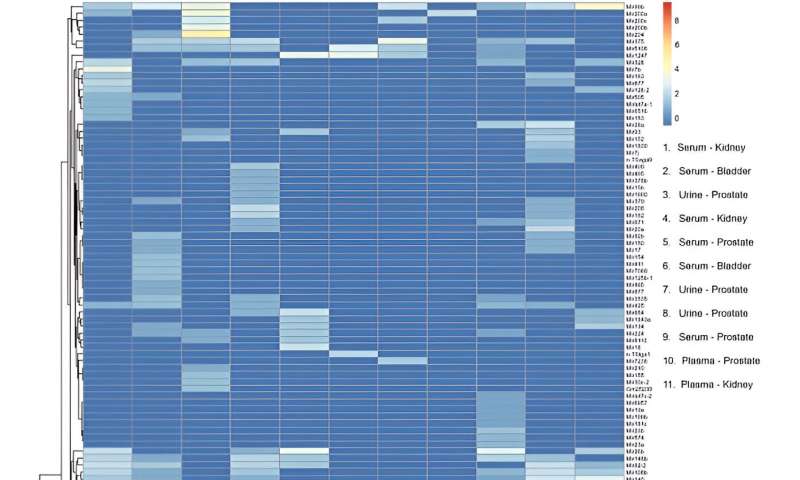
Heatmap van microRNA-transcripten geïsoleerd uit kleine extracellulaire blaasjes (sEV’s) in serum, plasma en urine van patiënten met kanker van het urogenitale kanaal. Kolommen vertegenwoordigen individuele monsters. De legenda toont het type biovloeistof en de kankerlocatie voor elk monster. Rijen vertegenwoordigen microRNA-gentranscripten. Kleurenbalkschaal vertegenwoordigt miRNA-verrijking. RStudio Desktop (versie 2023.06.2 + 561, toegankelijk via https://posit.co/download/rstudio-desktop/) werd gebruikt voor het genereren van heatmaps. Credit: Wetenschappelijke rapportendoi: 10.1038/s41598-023-45409-4
Het team zuiverde kleine extracellulaire blaasjes uit serum, plasma en urine in fosfaatgebufferde zoutoplossing met behulp van de op isolator gebaseerde diëlektroforetische benadering. Sharma en collega’s gebruikten transmissie-elektronenmicroscopie om de aanwezigheid van de blaasjes te bevestigen, en multiparametrische analyse van gezuiverde circulerende kleine extracellulaire blaasjes via flowcytometrie onderzocht.
Het team isoleerde de blaasjes en analyseerde ze, gevolgd door conventionele flowcytometriestudies. De onderzoekers toonden verder de capaciteit en het gebruik van het apparaat aan door de isolaten te karakteriseren ImageStream-software.
Na miRNA-sequencing heeft het team 137 verschillende, volwassen miRNA-transcripten in kaart gebracht aan het menselijk genoom in verschillende monsters om het apparaat in miRNA op te nemen. workflows voor biomarkeranalyse. Ze voerden transcriptomische profielen uit en voerden hoofdcomponentenanalyse uit.
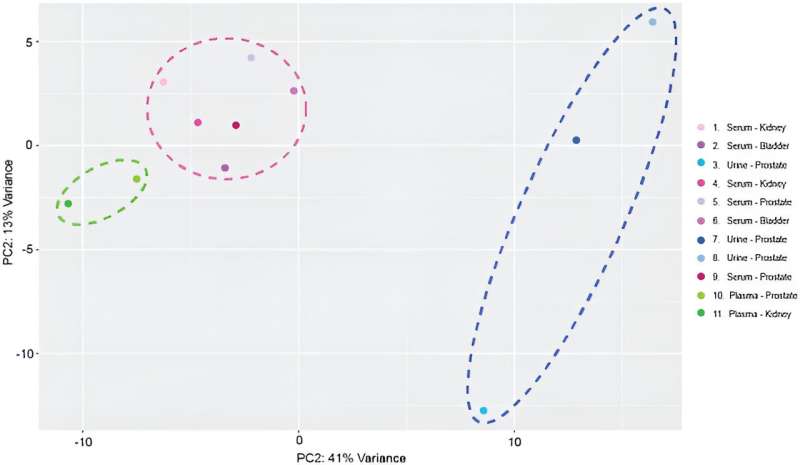
Geschaalde gecentreerde hoofdcomponentenanalyse van exosomale miRNA-profielen. Monsters geclusterd op basis van exosomale oorsprong. Groen onderbroken ovaal markeert monsters die uit plasma zijn geëxtraheerd. De roze gestippelde cirkel markeert monsters die uit serum zijn geëxtraheerd. Donkerblauw gestippeld ovaal markeert monsters die uit urine zijn geëxtraheerd. Credit: Wetenschappelijke rapportendoi: 10.1038/s41598-023-45409-4
Vooruitzichten
Op deze manier toonden Manju Sharma en collega’s de capaciteit en efficiëntie aan van een laagspannings, labelvrij isolatorgebaseerd diëlektroforetisch apparaat om kleine extracellulaire blaasjes te isoleren uit serum, plasma en urine van kankerpatiënten door middel van submicrondeeltjesdetectie. multiparametrische karakterisering met behulp van conventionele flowcytometrie en geavanceerde flowcytometriemethoden.
De RNA-concentraties van het werk waren vergelijkbaar met eerdere werken en bevestigden dat de isolatiemethode een haalbaar alternatief was voor de methoden die al in het laboratorium waren vastgesteld. De analytische methoden kunnen nuttig zijn als platforms voor vloeibare biopsie om kleine extracellulaire blaasjes te isoleren, en om op extracellulaire blaasjes gebaseerde diagnostische en monitoringplatforms te ontwikkelen.
Meer informatie:
Manju Sharma et al., Snelle zuivering en multiparametrische karakterisering van circulerende kleine extracellulaire blaasjes met behulp van een labelvrij laboratorium-op-een-chip-apparaat, Wetenschappelijke rapporten (2023). DOI: 10.1038/s41598-023-45409-4