Deze studie toont een innovatieve strategie om catiomer-gebaseerde nanodragers te verbeteren voor therapeutische mRNA-afgifte. Credit: Tokyo Tech
Van de enorm verschillende manieren om een ziekte aan te pakken, is het beheersen van de genetische expressie van cellen ongetwijfeld een van de krachtigste. In de afgelopen decennia hebben wetenschappers tientallen innovatieve strategieën bedacht die gebruikmaken van messenger RNA (mRNA) om cellen te “dwingen” om specifieke eiwitten te bouwen. Deze op mRNA gebaseerde therapieën hebben onlangs aan populariteit gewonnen als vaccins tegen infectieziekten zoals COVID-19. Bovendien hebben ze een aanzienlijk potentieel voor de behandeling van kanker en genetische aandoeningen.
Omdat mRNA zelf vrij onstabiel is en gemakkelijk wordt vernietigd door enzymen in het lichaam, vertrouwen op mRNA-gebaseerde therapieën op medicijnafgiftetechnieken; het kernidee is om mRNA-moleculen in nanostructuren in te kapselen en te beschermen die ze veilig in de doelcellen kunnen krijgen. Tegenwoordig zijn de meest onderzochte mRNA-nanodragers gemaakt van amine-dragende kationische lipiden of polymeren, die kleine beschermende bolletjes vormen die in cellen kunnen diffunderen om hun lading vrij te geven. Bestaande ontwerpen kampen echter nog steeds met stabiliteitsproblemen, wat de kosten verhoogt en leidt tot hogere doses om het gewenste effect te krijgen.
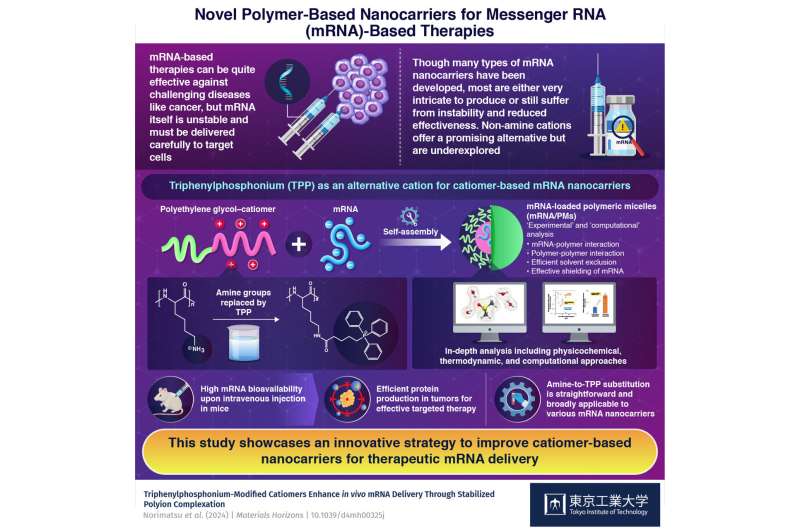
Tegen deze achtergrond heeft een onderzoeksteam uit Japan een alternatief voor amine-gebaseerde materialen onderzocht als mRNA nanocarriers. In hun laatste studie, gepubliceerd in Materialen Horizonnenonderzochten de onderzoekers het potentieel van trifenylfosfonium (TPP) als vervanging voor de aminegroepen die als kationen worden gebruikt om mRNA-geladen micellen te vormen.
“Kationen op basis van fosfonium bieden unieke ionische eigenschappen die interacties met anionen zoals mRNA bevorderen, zoals hun ladingsverdeling en bindingskracht aan anionen, die voortkomen uit verschillen in elektronegativiteit tussen fosfor en stikstof”, legt universitair hoofddocent Yasutaka Anraku van het Tokyo Institute of Technology uit, die de studie leidde. “Bovendien vergemakkelijken de drie fenylgroepen hydrofobe interacties, wat leidt tot stabiele mRNA-complexvorming. Het vervangen van amines door TPP zou dus de mRNA-afgifte-efficiëntie kunnen verhogen”, voegt hij toe.
Om hun hypothese te testen, ontwierpen de onderzoekers polymere micellen met behulp van polyethyleenglycol (PEG), TPP en mRNA. Eerst ontwikkelden ze een zeer efficiënte strategie om de aminegroepen in PEG-poly(L-lysine)-copolymeren te vervangen door TPP. De resulterende polymeren assembleren zichzelf op natuurlijke wijze tot een kern-schilstructuur in anionverrijkte omstandigheden vanwege hun hydrofobiciteit en ladingsverdeling. Bovendien, aangezien mRNA veel negatief geladen fosfaten bevat, trekken de positieve TPP-groepen hen aan om zichzelf te assembleren, wat zorgt voor een hoge en stabiele mRNA-lading in de micellen.
Hun strategie werd zorgvuldig beoordeeld en geverifieerd door middel van een uitgebreide analyse, inclusief thermodynamische, fysicochemische en computationele benaderingen. Bovendien testten ze ook de mogelijkheden van het voorgestelde systeem om mRNA in vivo aan tumorcellen te leveren met behulp van een muismodel.
“Bij intraveneuze injectie resulteerden TPP-dragende micellen in een opmerkelijke toename van de mRNA-biobeschikbaarheid, wat efficiënte eiwitproductie in solide tumoren mogelijk maakte,” benadrukt Anraku. Opvallend is dat de experimenten aantoonden dat de resterende intacte mRNA-niveaus in het bloed na 30 minuten ordes van grootte hoger waren bij gebruik van de voorgestelde TPP-gebaseerde micellen in plaats van amine-gebaseerde. Evenzo was de eiwitexpressie in tumorweefsels meer dan 10 keer hoger bij gebruik van TPP-gebaseerde micellen.
Al met al lijkt het erop dat deze innovatieve strategie veel potentieel heeft op het gebied van mRNA-therapieën, waaronder gerichte toediening van medicijnen.
“Aangezien polymere micellen gericht kunnen worden op specifieke weefsels door liganden te bevestigen, kunnen TPP-dragende polymere micellen dienen als een robuust platform voor mRNA-afgifte in verschillende weefsels,” zegt Anraku. Met een beetje geluk zal deze technologie de weg vrijmaken voor effectieve behandeling van de meest uitdagende ziekten van de mensheid.
Meer informatie:
Jumpei Norimatsu et al, Trifenylfosfonium-gemodificeerde catiomeren verbeteren de in vivo mRNA-afgifte door gestabiliseerde polyioncomplexatie, Materialen Horizonnen (2024). DOI-nummer: 10.1039/D4MH00325J
Informatie over het tijdschrift:
Materialen Horizonnen
Aangeboden door Tokyo Institute of Technology