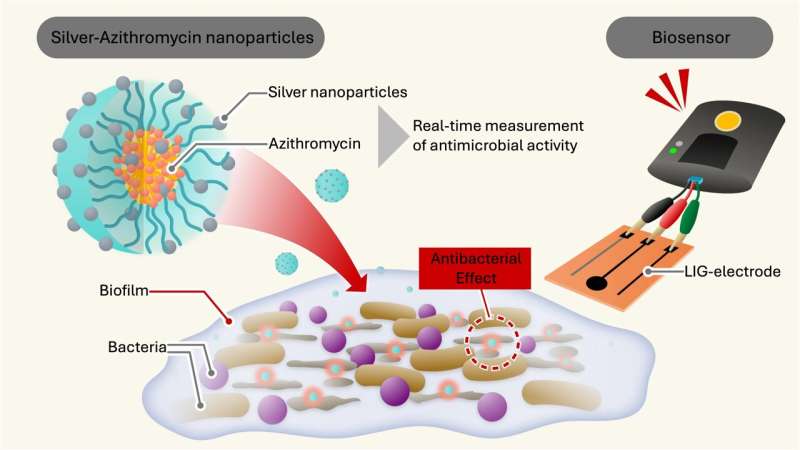
Zilveren nanodeeltjes, gecombineerd met een conventioneel antibioticum en gestabiliseerd door een polymeer, werken samen om de celwanden van bacteriën in biofilms te beschadigen. Credit: National Institute of Advanced Industrial Science and Technology (AIST)
Van het veiligstellen van onze voedselvoorziening tot het voorkomen van ziekenhuisinfecties, de strijd tegen antibioticaresistente bacteriën is een groeiende uitdaging. Sommige bacteriën kunnen biofilms vormen, dikke aggregaten van miljoenen individuele cellen omgeven door beschermende slijmachtige substanties die zich gemakkelijk aan oppervlakken hechten. Het vormen van dergelijke biofilms is een cruciale bacteriële strategie om behandeling te weerstaan.
De dichte, gelaagde kolonies beschermen bacteriën tegen immuuncellen en verminderen de effectiviteit van antiseptica en antibiotica. “Zodra een biofilm zich vormt, fungeert de structuur ervan als een barrière, waardoor het extreem moeilijk wordt voor medicijnen om de bacteriën binnen te dringen en te doden,” legt Dr. Chisato Takahashi uit, een hoofdonderzoeker bij het National Institute of Advanced Industrial Science and Technology (AIST). De buitengewone veerkracht van de biofilms heeft onderzoekers gemotiveerd om innovatieve oplossingen te zoeken die verder gaan dan traditionele antibiotica.
In hun recent gepubliceerd artikel in het dagboek NanoschaalEen team van wetenschappers van het Okinawa Institute of Science and Technology (OIST) en AIST heeft een nieuwe aanpak ontwikkeld om behandelingsresistente bacteriën te bestrijden.
Om de tekortkomingen van conventionele antibiotica te overwinnen, ontwikkelden de onderzoekers een uniek nanodeeltje dat meerdere mechanismen combineert om de bacteriën te doden.
“We hebben onze zilverdeeltjes ingekapseld in een polymeeromhulsel van Soluplus en hebben het geïnfuseerd met azithromycine, een antibioticum. Deze innovatieve inkapselingsstrategie maakt de nanodeeltjes stabiel en zeer effectief in hun antimicrobiële activiteit,” zegt Dr. Takahashi.
Nadat we de stabiliteit van deze nanodeeltjes in een eerdere studie hadden aangetoond, was het tijd om hun effectiviteit te testen. “We kozen twee bekende bacteriën die vaak problematische ziekenhuisinfecties veroorzaken: Escherichia coli en Staphylococcus epidermidis,” zegt Dr. Murali Mohan Jaligam, een postdoctoraal onderzoeker bij de Micro/Bio/Nanofluidics Unit van OIST en de eerste auteur van de studie.

De nanodeeltjes geven zilverionen af die het celmembraan van de bacterie verstoren, hun DNA beschadigen en eiwitten denatureren. Credit: Chisato Takahashi (AIST), Mohan et al. 2024, Nanoschaal
Deze bacteriën staan erom bekend dat ze veerkrachtige biofilms vormen op oppervlakken zoals katheters en chirurgische implantaten, wat leidt tot ernstige, behandelingsresistente infecties in het menselijk lichaam. Antibiotica werken zeer specifiek bij het verwijderen van bacteriën, wat de beschikbare behandelingsopties tijdens bacteriële infectie beperkt, een beperking die vooral kritisch wordt wanneer antibioticaresistentie ontstaat.
In die situaties kunnen de geavanceerde nanodeeltjes conventionele methoden overtreffen.
“Onze nanodeeltjes kunnen een dubbele aanval uitvoeren: bacteriële cellen aanvallen met zowel antibiotica als zilverionen. Het inkapselende polymeer zorgt voor stabiliteit en voorkomt dat de nanodeeltjes klonteren, waardoor hun effectiviteit wordt verbeterd”, aldus Prof. Amy Shen, hoofd van de OIST Micro/Bio/Nanofluidics Unit.
Alleen door zilver, antibiotica en polymeer te combineren, konden de onderzoekers hun nanodeeltjes de unieke mogelijkheid geven om bacteriële biofilms binnen te dringen en te verstoren.
“Het zijn niet zomaar nanodeeltjes die dit kunnen doen”, voegt Dr. Takahashi toe.

Wetenschappers gebruikten een CO2 laser om de elektroden op een polyimidevel te maken en deze te verbinden met een sensor die de verandering in elektrochemische signalen tijdens een experiment meet. De resultaten kunnen draadloos naar de computer van de onderzoeker worden verzonden.Jaligam Murali Mohan (OIST), Kazumi Toda Peters (OIST), Sensit BT door PalmSens BV, Mohan et al. 2024, Nanoschaal
Visualiseren van succes: een nieuwe methode voor realtime monitoring
De onderzoekers gebruikten scanning elektronenmicroscopie en optische dichtheidsmetingen om te observeren hoe de nanodeeltjes biofilms verstoren. Hoewel deze methoden goed ingeburgerd zijn, kunnen ze tijdrovend zijn en vereisen ze dat het monster wordt gekleurd met speciale kleurstoffen. Door laser-geïnduceerde grafeen (LIG) elektroden te ontwikkelen, kon het team bestaande technische beperkingen overwinnen.
“We hebben een geminiaturiseerd, uiterst gevoelig LIG-elektrodesysteem gecreëerd dat bacteriële activiteit in realtime kan monitoren”, legt Dr. Jaligam uit. Deze elektroden hebben grote oppervlakken, waardoor bacteriën een ideale basis hebben om biofilms te vormen, en zijn zeer geleidend, zodat ze de stroom van elektrische ladingen gemakkelijk kunnen meten.
Omdat rottende bacteriën een ander elektrochemisch signaal creëren dan intacte bacteriën, kan de elektrode de afbraak van de bacteriecel detecteren als de elektrische stroom verandert. Deze methode is sneller en nauwkeuriger dan traditionele methoden om antimicrobiële activiteit te beoordelen en werkt zonder de bacteriën te kleuren.
“Onze LIG-sensortechnologie biedt een efficiënte, schaalbare en kosteneffectieve oplossing voor het detecteren en beheren van bacteriële contaminatie en biofilms”, merkt Prof. Shen op. Deze kwaliteiten openen verschillende velden voor het gebruik van elektroden, zoals kankerscreening. Nanodeeltjes hebben ook potentiële toepassingen die verder gaan dan het bestrijden van ziekenhuisinfecties, bijvoorbeeld bij het coaten van medische apparaten om te voorkomen dat biofilms zich in de eerste plaats vormen.
“Antibioticaresistentie blijft een kritieke bedreiging vormen voor de wereldwijde gezondheid, maar doorbraken als deze bieden een veelbelovend pad voorwaarts. Onze studie toont het potentieel van collaboratief, interdisciplinair onderzoek om enkele van de meest urgente en complexe uitdagingen aan te pakken waarmee we momenteel in de moderne geneeskunde worden geconfronteerd”, aldus Prof. Shen.
Meer informatie:
Murali Mohan Jaligam et al, Verbeterde antibacteriële werkzaamheid: snelle analyse van met zilver versierde, met azitromycine geïnfuseerde Soluplus®-nanodeeltjes tegen E. coli en S. epidermidis-biofilms, Nanoschaal (2024). DOI-nummer: 10.1039/D4NR02583K
Informatie over het tijdschrift:
Nanoschaal
Geleverd door Okinawa Instituut voor Wetenschap en Technologie