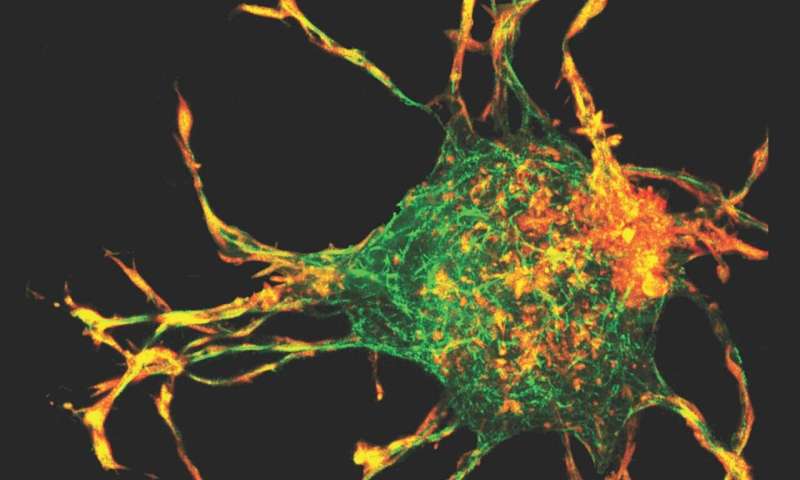
Onderzoekers gebruikten een 3D-mappingtechniek – de eerste keer dat het op collageen werd toegepast – samen met een computermodel om de 3D-rek- en stressvelden te berekenen die werden gecreëerd door uitsteeksels uit de cellen. Krediet: hoffelijkheidsbeeld
Wanneer we een wond op onze huid krijgen, mobiliseren de cellen in ons lichaam snel om het te herstellen. Hoewel bekend is hoe cellen wonden helen en hoe littekens ontstaan, heeft een team onder leiding van onderzoekers van de Washington University in St. Louis voor het eerst bepaald hoe het proces begint, wat nieuw inzicht kan geven in wondgenezing, fibrose en uitzaaiing van kanker. .
Het team, geleid door Delaram Shakiba, een postdoctoraal onderzoeker van het NSF Science and Technology Center for Engineering Mechanobiology (CEMB) van de McKelvey School of Engineering, ontdekte de manier waarop fibroblasten, of gewone cellen in bindweefsel, omgaan met de extracellulaire matrix, die biedt structurele ondersteuning en biochemische en biomechanische signalen aan cellen. Het team ontdekte een recursief proces dat zich afspeelt tussen de cellen en hun omgeving, evenals structuren in de cellen die voorheen onbekend waren.
De resultaten van het onderzoek zijn gepubliceerd in ACS Nano op 28 juli. Senior auteurs op het papier zijn Guy Genin, de hoogleraar Werktuigbouwkunde van Harold en Kathleen Faught aan de McKelvey School of Engineering, en Elliot Elson, emeritus hoogleraar biochemie en moleculaire biofysica aan de School of Medicine.
“Klinische inspanningen om de progressie van fibrocontractiele ziekten, zoals littekens en fibrose, te voorkomen, zijn grotendeels mislukt, deels omdat de mechanismen die cellen gebruiken om met de eiwitvezels om hen heen in wisselwerking te staan, onduidelijk zijn,” zei Shakiba. “We ontdekten dat fibroblasten volledig verschillende mechanismen gebruiken in de vroege – en ik denk dat de meest behandelbare – stadia van deze interacties, en dat hun reacties op medicijnen daarom het tegenovergestelde kunnen zijn van wat ze in de latere stadia zouden zijn.”
Genin, de co-directeur van de CEMB, zei dat het proces al geruime tijd mechanobiologische onderzoekers heeft belemmerd.
“Onderzoekers op het gebied van de mechanobiologie dachten dat cellen collageen uit de extracellulaire matrix trokken door lange uitsteeksels uit te reiken, het vast te grijpen en terug te trekken”, zei Genin. “We ontdekten dat dit niet het geval was. Een cel moet zich eerst een weg naar buiten banen door collageen, en in plaats van zich vast te grijpen, schiet hij in wezen minuscule haartjes of filopodia uit de zijkanten van zijn armen, trekt collageen naar binnen dat weg en trekt zich dan terug. “
Nu ze dit proces begrijpen, zei Genin, kunnen ze de vorm bepalen die een cel aanneemt.
‘Met onze collega’s van CEMB aan de Universiteit van Pennsylvania konden we enkele wiskundige modellen valideren om het engineeringproces te doorlopen, en we hebben nu de basisregels die cellen volgen’, zei hij. “We kunnen nu beginnen met het ontwerpen van specifieke stimuli om een cel ertoe te brengen zich op een bepaalde manier te gedragen bij het opbouwen van een weefsel-engineered structuur.”
De onderzoekers leerden dat ze de celvorm op twee manieren konden beheersen: ten eerste door de grenzen eromheen te controleren, en ten tweede door bepaalde eiwitten die betrokken zijn bij de hermodellering van het collageen te remmen of te reguleren.
Fibroblasten trekken de randen van een wond samen, waardoor deze samentrekt of dichtgaat. Collageen in de cellen remodelleert vervolgens de extracellulaire matrix om de wond volledig te sluiten. Hier komt de mechanobiologie in het spel.
‘Er is een evenwicht tussen spanning en compressie in een cel die pas is blootgesteld aan vezelige eiwitten’, zei Genin. “Er is spanning in actinekabels en door met die balans te spelen, kunnen we deze uitsteeksels extreem lang laten groeien,” zei Genin. ‘We kunnen ervoor zorgen dat de verbouwing niet meer plaatsvindt of we kunnen het verhogen.’
Het team gebruikte een 3D-mappingtechniek – de eerste keer dat het op collageen werd toegepast – samen met een computermodel om de 3D-spanning en stressvelden te berekenen die door de uitsteeksels van de cellen werden gecreëerd. Terwijl cellen collageen accumuleerden, leidde spanningsgestuurde hermodellering en uitlijning van collageenvezels tot de vorming van collageenkanalen. Dit vereist coöperatieve interacties tussen cellen, waardoor cellen mechanisch kunnen interageren.
“Nieuwe methoden voor microscopie, weefseltechniek en biomechanische modellering vergroten ons begrip van de mechanismen waarmee cellen de weefsels die ze bevolken, modificeren en herstellen,”, zei Elson. “Vezelcelstructuren genereren en sturen krachten die hun extracellulaire vezelige omgeving comprimeren en heroriënteren. Dit roept nieuwe vragen op over de moleculaire mechanismen van deze functies en hoe cellen de krachten die ze uitoefenen reguleren en hoe ze de mate van matrixvervorming regelen.”
“Wondgenezing is een goed voorbeeld van hoe deze processen fysiologisch belangrijk zijn,” zei Genin. ‘We zullen inzicht kunnen krijgen in hoe we cellen kunnen trainen om het collageen om hen heen niet overmatig te verdichten.’
Delaram Shakiba et al, The Balance between Actomyosin Contractility and Microtubule Polymerization Reguleert hiërarchische uitsteeksels die efficiënte fibroblast-collageeninteracties regelen, ACS Nano (2020). DOI: 10.1021 / acsnano.9b09941
ACS Nano
Geleverd door Washington University in St. Louis