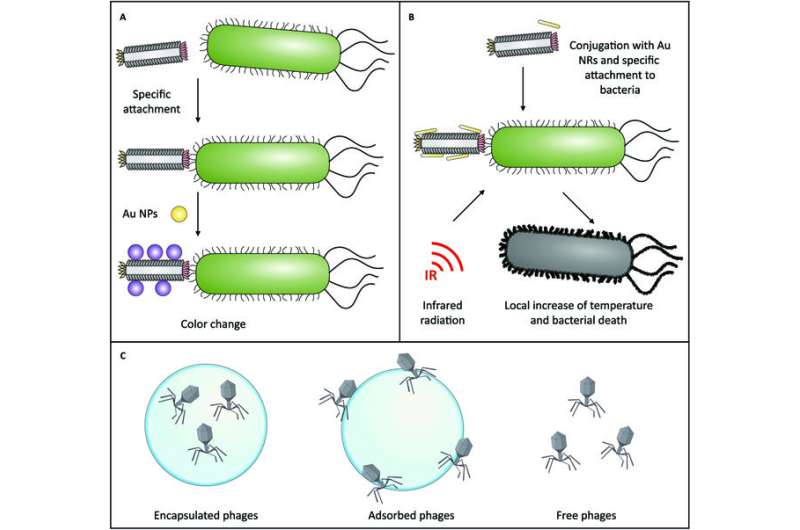
Voorbeelden van de combinatie van nanotechnologie met fagen. (A) Gebruik van fagen geconjugeerd met gouden NP’s voor de identificatie van bacteriën (detectie, detectie, typering) op basis van kleurveranderingen als gevolg van hun oppervlakte-plasmonresonantie-eigenschappen. (B) Gebruik van fagen geconjugeerd met gouden nanostaafjes (AuNR’s) voor gefocaliseerde fotothermische therapie. (C) Inkapseling en adsorptie van fagen in NP’s en MP’s voor verbeterde klinische output van faagtherapie in tegenstelling tot vrije faagtoediening. Credit: BioDesign-onderzoek (2023). DOI: 10.34133/bdr.0004
Het overmatig gebruik van antibiotica gedurende langere tijd heeft geleid tot de opkomst van multiresistente (MDR) bacteriën in de afgelopen jaren. Dit vormt een aanzienlijke bedreiging voor de volksgezondheid, met meer dan 1,2 miljoen doden als gevolg van MDR-bacteriën. Bovendien is de voortgang in het onderzoek naar en de ontwikkeling van nieuwe antibiotica vertraagd; de meeste “nieuwe” antibiotica zijn modificaties van eerdere bestaande medicijnen, waarbij slechts een handvol nieuwe chemische formuleringen wordt geproduceerd.
Er is echter hoop in de vorm van een klein organisme dat bacteriofagen wordt genoemd. Deze virussen infecteren specifiek bacteriën en vormen daarom een levensvatbaar alternatief tegen MDR-bacteriën. Faagtherapie kan ook helpen bij het voorkomen van bijwerkingen zoals dysbiose (de verstoring van de “goede bacteriën” van ons eigen lichaam door antibiotica), en is milieuvriendelijk. Hun soortspecificiteit is echter een tweesnijdend zwaard en kan potentiële wegversperringen vormen voor de klinische toepassing van bacteriofagen, in combinatie met hun lage biologische beschikbaarheid en het risico van verlies van infectiviteit.
Maar faagtherapie is een werk in uitvoering en om deze obstakels te overwinnen, worden alternatieve combinaties onderzocht. Nanotechnologie is nu naar voren gekomen als een levensvatbare aanvulling op faagtherapie, en een recensie, die online verscheen op 4 januari 2023 en werd gepubliceerd in de Biodesign-onderzoek tijdschrift, heeft tot doel onderzoek te verzamelen naar biosensoren en antibiotische therapie waarbij zowel nanodeeltjes (NP’s) als bacteriofagen worden gebruikt om bacteriën te detecteren en te doden of te deactiveren.
De overeenkomstige auteur van dit artikel, Dr. Pilar Domingo-Calap van het Instituut voor Integratieve Systeembiologie in Spanje, stelt: “Goud- en/of zilveren NP’s kunnen zich binden aan bacteriën en fagen, waardoor de detectie van de eerste en de diagnose van bacteriële infectie wordt vergemakkelijkt. Deze NP’s kunnen worden gedetecteerd via colorimetrische, spectrometrische of elektrochemische middelen. Deze NP’s kunnen ook worden vastgemaakt aan herkenningselementen zoals aptameren, antilichamen, enzymen en DNA-fragmenten, die een efficiëntere herkenning en binding aan bacteriën en bacteriofagen mogelijk maken.”
Tot nu toe zijn deze met succes gebruikt om bacteriën zoals Escherichia coli, Pseudomonas aeruginosa, Vibrio cholerae en Xanthomonas campestris te detecteren. Bovendien zijn benaderingen die deze NP’s gebruiken eenvoudig te bedienen en op te slaan, snel en draagbaar, wat hun diagnostisch potentieel benadrukt.
NP’s kunnen ook synchroon werken met bacteriofagen om bacteriën te doden, via fotothermische therapie (PTT), waarbij warmte vrijkomt, of fotodynamische therapie, waarbij warmte of reactieve zuurstofsoorten vrijkomen. Hoewel de vorming van bacteriële biofilms dit proces afremt door het penetratievermogen van de NP’s te verminderen, wordt het gebruik van enzymen om deze structuren te verstoren onderzocht, waarbij DNase veelbelovend lijkt.
Een combinatie van dit enzym met gouden NP’s is succesvol gebleken bij het verstoren van biofilms en het doden van bacteriestammen zoals Staphylococcus aureus, Staphylococcus epidermidis, E. coli en P. aeruginosa via PTT/PDT. Verschillende faag-NP-combinaties worden ook getest, met een M13 faag-goud nanorod (“Phanorod”) formulering die veelbelovend is. Verdere in vivo studies zijn echter nodig om ervoor te zorgen dat deze formuleringen geen immunologische bijwerkingen hebben.
Dr. Domingo-Calap bespreekt ook een andere manier om faagtherapie te verbeteren. “Inkapseling van fagen kan de eliminatie van bacteriofagen verminderen, zorgen voor hun gecontroleerde afgifte en dus zorgen voor een constante aanvoer van therapeutische middelen tegen infectie.”
De fagen kunnen worden ingekapseld in polymeren, dit zijn macromoleculaire structuren met een grote verhouding tussen oppervlak en volume, waardoor ze efficiënt kunnen worden geladen en afgeleverd. Deze polymeren kunnen echter ook de effectiviteit van de behandeling verminderen. Ze kunnen echter synthetisch worden gegenereerd, waardoor hun eigenschappen beter kunnen worden gecontroleerd. In polymeer ingekapselde fagen zijn zeer effectief gebleken tegen longinfecties veroorzaakt door P. aeruginosa bij patiënten die lijden aan cystische fibrose.
Deze technologie heeft ook verstrekkende gevolgen voor de uiteindelijke ontwikkeling van op fagen gebaseerde vaccins. De auteurs herhalen echter het belang van het selecteren van een geschikt oplosmiddel tijdens de synthese van deze polymeren, aangezien bekend is dat organische oplosmiddelen faagdeeltjes inactiveren, waardoor de effectiviteit van het therapeutische middel afneemt.
Er is ook een groeiende belangstelling voor op lipiden gebaseerde structuren voor de inkapseling en afgifte van fagen. Liposomen, dit zijn dubbellaagse fosfolipiden ingesloten in een waterige holte, kunnen worden gesynthetiseerd met verschillende technieken. Hun kleine formaat maakt hechting aan slijmrijke oppervlakken mogelijk, evenals opname door fagocytische cellen, waardoor ze intracellulaire pathogenen kunnen bereiken, zoals Mycobacterium tuberculosis, Listeria spp., Salmonella spp. en Staphylococcus spp.
Liposomen die zijn samengesteld uit cholesterol of polyethyleenglycol (PEG) zijn effectief gebleken bij faag-gemedieerde behandeling van gastro-intestinale infecties, waardoor effectieve diffusie en biologische beschikbaarheid naar verschillende weefsels worden vergemakkelijkt, evenals bescherming van de faagdeeltjes tegen het immuunsysteem van de gastheer. Een belangrijke beperking die door hen wordt benadrukt, is echter de kleine omvang van de liposomen, die het type faag beperkt dat kan worden ingekapseld, afhankelijk van de grootte ervan.
Dr. Domingo-Calap concludeert door te veronderstellen: “Op fagen gebaseerde nanotechnologie kan een veelbelovend en efficiënt alternatief zijn voor het overwinnen van antimicrobiële resistentie. Het kan worden benut bij de preventie, diagnose en behandeling van bacteriële ziekten. Hoewel er nog een lange weg te gaan is. go, vooral op het regelgevende niveau, staat op faag gebaseerde nanotechnologie in de schijnwerpers en toekomstig onderzoek in het veld zal de ontwikkeling van nieuwe antimicrobiële producten verbeteren.”
Meer informatie:
Marco Pardo-Freire et al, Fagen en nanotechnologie: nieuwe inzichten tegen multidrug-resistente bacteriën, BioDesign-onderzoek (2023). DOI: 10.34133/bdr.0004
Aangeboden door NanJing Agricultural University