Krediet: Wiley
Chronisch geïnfecteerde wonden zijn vaak zeer problematisch voor diabetespatiënten. Een team van Chinese onderzoekers heeft nu echter een gerichte benadering van wondgenezing ontwikkeld die gebruik maakt van nanomedicine, en hun onderzoek is gepubliceerd in het tijdschrift Angewandte Chemie. De onderzoekers waren in staat om wondinfecterende bacteriën te deactiveren met behulp van een oplossing van nanocapsules die de wondomgeving veranderen en reactieve zuurstofsoorten ontketenen.
Chronische wonden bij diabetespatiënten zijn een ideale plek voor bacteriën om te groeien. Door de glucoserijke omgeving kunnen bacteriën biofilms vormen, waardoor het voor antibiotica erg moeilijk wordt om te komen waar ze nodig zijn. Bovendien hebben patiënten met diabetes vaak een verzwakt immuunsysteem. In deze gevallen biedt chemodynamische therapie een veelbelovende aanpak. In situ gegenereerde reactieve zuurstofsoorten verzwakken en beschadigen de bacteriecellen, waardoor ze afsterven.
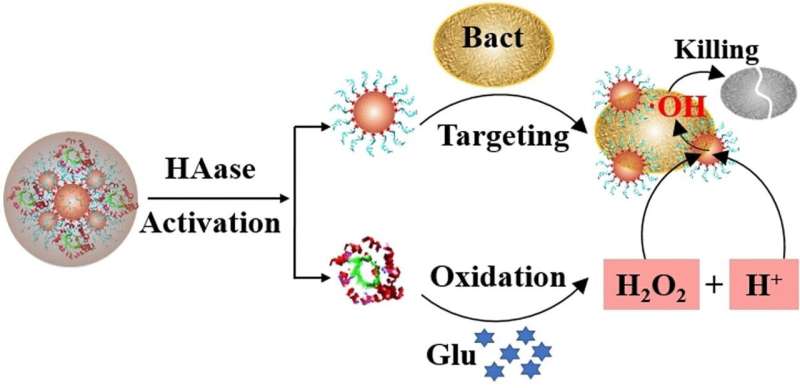
Een katalysator is verantwoordelijk voor het produceren van deze reactieve zuurstofsoorten. Het breekt waterstofperoxide af in de directe omgeving van de bacteriecellen, bij voorkeur direct op of in hun celwand. Platina nanodeeltjes zijn bijzonder geschikt als katalysator voor deze rol. Aan deze nanoparels zijn aptameren bevestigd: korte DNA-ketens die zich binden aan bacteriën. Deze katalysatordeeltjes – nanozymen – werken op dezelfde manier als enzymen, vandaar hun naam. Het nanozyme plakt aan de bacteriën en geeft zuurstofradicalen af in de cel, zolang waterstofperoxide ook aanwezig is om de radicalen in de eerste plaats te produceren.
Het belangrijkste probleem is dat de katalysator het waterstofperoxide alleen kan afbreken in een zure omgeving (dwz bij een lage pH). De meeste diabetische wonden zijn echter alkalisch. Om het nanozymsysteem onder deze omstandigheden toch effectief te laten zijn, doken Ronghua Yang van de Changsha University of Science and Technology in Changsha (China) en collega’s in hun biochemische trukendoos en maakten gebruik van de glucoserijke omgeving van diabetische wonden .
Het microbiële enzym glucose-oxidase, dat al bekend is in de medische diagnostiek en de voedingsindustrie, gebruikt zuurstof om glucose om te zetten in gluconzuur, waarbij waterstofperoxide en een zure oplossing worden gevormd. Yang en het team hechtten glucose-oxidase aan de nanozymen en sloten vervolgens het hele systeem in een beschermend omhulsel van hyaluronzuur.
Door de schaal konden de nanozymdeeltjes niet alleen ongeveer vijfvoudig groeien tot 0,1 micrometer (ongeveer een tiende van de grootte van een bacterie), maar bleven ze ook meer dan 30 dagen stabiel en onveranderd in oplossing. De hyaluronzuurschil diende nog een ander doel: bacteriën produceren enzymen die hyaluronzuur afbreken, wat betekent dat de bacteriën in wezen de instrumenten van hun eigen ondergang ontketenen.
De nanocapsule-oplossing werd getest op bacterieculturen van Staphylococcus aureus en doodde de bacteriën binnen enkele uren. Het team behandelde vervolgens chronisch geïnfecteerde wonden bij diabetische muizen en de resultaten waren beslissend: onder identieke omstandigheden genazen alleen de wonden die met de nanocapsule-oplossing waren behandeld volledig en snel.
De auteurs benadrukten dat de methode niet de synthese van nieuwe materialen vereiste; in plaats daarvan “losten ze fysiologische beperkingen op nanozymen op door de lokale micro-omgeving te reguleren.” Ze suggereerden ook dat modificaties van dit type geschikt zouden zijn voor andere nanozymsystemen.
Lifang Chen et al, A Glucose-Powered Activatable Nanozyme Breaking pH en H 2 O 2 Limits for the Treatment Diabetic Infections, Internationale editie van Angewandte Chemie (2021). DOI: 10.1002/anie.202107712
Angewandte Chemie
,
Internationale editie van Angewandte Chemie
Aangeboden door Wiley