Grafische samenvatting: Krediet: ACS Nano (2023). DOI: 10.1021/acsnano.3c01186
Veel ziekten kunnen met succes worden behandeld in de eenvoudige omgeving van een celkweekschaal, maar om echte mensen met succes te behandelen, moet het medicijn een reis maken door de oneindig complexere omgeving in ons lichaam en intact in de aangetaste cellen aankomen. Dit proces, medicijnafgifte genoemd, is een van de belangrijkste belemmeringen in de geneeskunde.
Een samenwerking tussen het Lawrence Berkeley National Laboratory (Berkeley Lab) en Genentech, een lid van de Roche Group, werkt aan het doorbreken van enkele knelpunten in de medicijnafgifte door de meest effectieve lipide nanodeeltjes (LNP’s) te ontwerpen: kleine bolvormige zakjes gemaakt van vetmoleculen die therapeutische middelen inkapselen totdat ze aan celmembranen koppelen en hun inhoud vrijgeven. Het eerste medicijn dat LNP’s gebruikte, werd in 2018 goedgekeurd, maar de toedieningsmethode kreeg wereldwijde bekendheid met de Pfizer en Moderna mRNA COVID-vaccins.
“Het is best een slim systeem, want als je het RNA zelf gewoon aan het menselijk lichaam levert, wordt het RNA afgebroken door nucleasen en kan het niet gemakkelijk het celmembraan passeren vanwege zijn grootte en lading, maar de LNP’s brengen het veilig in de cel. “verklaarde mede-hoofdauteur Chun-Wan Yen, een senior Principal Scientist in Genentech’s Small Molecule Pharmaceutical Sciences-groep.
LNP’s worden nu op grote schaal onderzocht als een toedieningssysteem voor vaccins voor andere infectieziekten of therapeutische vaccins voor kanker. De levensvatbaarheid van deze nieuwe toepassingen zal afhangen van hoe goed de lipide-enveloppen samensmelten met doelcellen, hoe stabiel de medicijn-LNP-formuleringen zijn bij opslag (zodat ze lang houdbaar zijn) en hoe stabiel ze zijn in het lichaam. (zodat ze langdurige medicijnactiviteit kunnen verlenen).
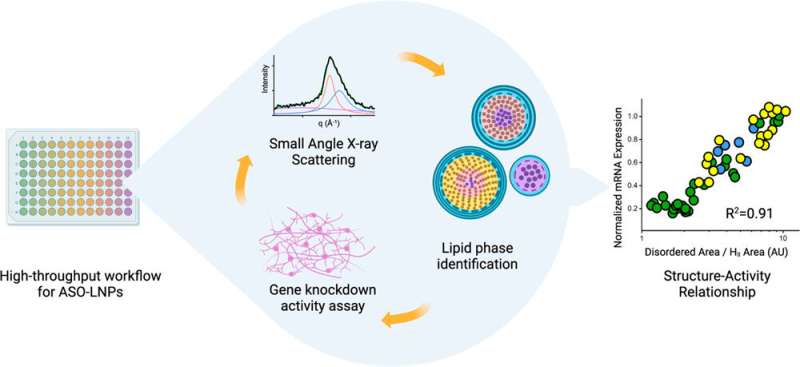
Al deze eigenschappen worden gecontroleerd door het mengsel van moleculen dat wordt gebruikt om de LNP te creëren, en de resulterende 3D-structuur van het deeltje. Het team onder leiding van Yen en collega-co-leiders Greg Hura en Michal Hammel, beide biofysici van Berkeley Lab, bestuderen al enkele jaren hoe de structuur van LNP’s kan worden afgestemd op gewenste eigenschappen.
Hun nieuwste paper, onlangs gepubliceerd in ACS Nano, documenteert hoe een high-throughput workflow hen in staat stelt om LNP’s in recordsnelheid te produceren en te karakteriseren. De studie omvat ook de allereerste demonstratie van hoe de LNP-structuur correleert met de activiteit van de inhoud ervan, wat voor dit onderzoek een anti-sense oligonucleotide (ASO) was. ASO’s zijn kleine stukjes RNA of DNA-basenparen die genexpressie blokkeren door zich te binden aan strengen mRNA en te voorkomen dat ze worden vertaald in eiwitten. ASO’s zijn een geweldige manier om ziekten te behandelen die worden veroorzaakt door defecte eiwitten of een teveel aan eiwitten. Maar net als mRNA zijn ze vatbaar voor zwervende nucleasen – enzymen die RNA en DNA afbreken – en cellen nemen ze niet gemakkelijk op.
De wetenschappers ontdekten dat ASO-dragende LNP’s met netjes geordende, dicht op elkaar gepakte interne structuren leidden tot een betere uitschakeling van een defect gen in menselijke neuronen dat geassocieerd is met een degeneratieve ziekte, in vergelijking met LNP’s die een meer ongeordende structuur hadden. De bevindingen waren afkomstig van cellulaire activiteiten, niet van dierstudies, dus er is nog meer werk in het verschiet, maar het team is verheugd om voort te bouwen op deze inzichten met behulp van de aanvullende tools van elke instelling.

Deze cryo-elektronenmicroscopiebeelden tonen de meerlagige structuren van de lipidenanodeeltjes die de wetenschappers produceerden en bestudeerden. De microscopie werd uitgevoerd in het cryo-EM Research Center (CEMRC) van de afdeling Biochemie van de Universiteit van Wisconsin-Madison. Krediet: Michal Hammel/Berkeley Lab
“We genereren de LNP’s in high-throughput en het team van Greg en Michal kan de high-throughput-analyse bieden”, aldus Yen. “Als je tegenwoordig naar de publicatie kijkt, doen ze meestal maar een of twee formuleringen, maar voor ons is het anders. We kunnen grote datasets genereren, en ik denk dat dat de reden is waarom we deze zeer unieke en coole bevinding kunnen hebben.”
“Dit document beschrijft echt de methode die we gaan toepassen op de duizenden andere formuleringen die we willen karakteriseren”, voegde Hura toe, die deel uitmaakt van Berkeley Lab’s Biosciences Area. “We hopen dat dit een algemene methode zal zijn voor mensen om hun lipidenanodeeltjes te optimaliseren. Of dat nu vaccins zijn, en nogmaals, de vaccins hebben tot nu toe de meeste aandacht gekregen, of verder. Dit type therapie heeft een zeer brede toepassing daarbuiten .”
Hoe een lipidenanodeeltje te bouwen
De structuren van LNP’s worden beïnvloed door hoe je ze mixt, wat je mixt en in welke volgorde. LNP’s hebben vier ingrediënten – ioniseerbare lipiden, helperfosfolipiden, cholesterol en polyethyleenglycollipiden (PEG-lipiden) – en elk ingrediënt heeft verschillende vormen. Bovendien kunnen ze in verschillende verhoudingen worden gecombineerd, wat leidt tot een exponentieel aantal mogelijke formules. Om de zaken nog ingewikkelder te maken, veranderen de LNP’s met de tijd. Een formulering die begint als een nette, dicht opeengepakte bol, zal uiteindelijk veranderen in een meer ongeordende structuur.
Wetenschappers van Genentech ontwikkelden een robotgestuurde workflow die in slechts enkele uren honderden LNP-formuleringen kan genereren. Monsters van elke formulering worden vervolgens naar Berkeley Lab gebracht om small-angle X-ray scattering (SAXS) uit te voeren bij de Advanced Light Source, een cirkelvormige deeltjesversneller die röntgenbundels met verschillende energieën creëert.
De biologische SAXS-bundellijn kan snel veel monsters verwerken, en in tegenstelling tot andere vormen van röntgendiffractie op biologische materialen, hoeven de monsters niet te worden bevroren of gekristalliseerd – wat de structuur van de LNP’s zou kunnen veranderen en zou kunnen voorkomen dat de wetenschappers ontdekken wat de LNP’s zouden eruit zien bij fysiologische temperaturen in het menselijk lichaam. Met SAXS kunnen ze ook snapshots maken van LNP’s op een bepaald tijdstip om hun structurele levensduur te bepalen.
Bovendien gebruikt het Genentech-team een versneld proces om te bestuderen hoe LNP’s de genexpressie in hun doelcellen beïnvloeden. Door al deze versnelde technieken te combineren, kan de hele samenwerking potentiële LNP’s in een ongekend tempo screenen.
Yen is van plan de SAXS-bundellijn te blijven gebruiken om kleine details te bestuderen, zoals hoe een verandering van 1% in de concentratie van ingrediënten of het gebruik van een nieuwe machine tijdens de productie de cellulaire activiteit van LNP kan beïnvloeden, evenals grote vragen, zoals of LNP’s zich anders gedragen als ze andere soorten vracht vervoeren en hoe deze interageren met verschillende doelcellen.
“We weten dat mRNA-LNP’s werken, maar er is nog steeds een enorme kenniskloof”, zei Yen. “Daarom heb ik het gevoel dat onze krant een pionier is op dit gebied en hopelijk kunnen we ook meer gegevens en begrip genereren voor toekomstige toepassingen.”
Meer informatie:
Michal Hammel et al., De structuur en genuitschakelingsactiviteit van oligonucleotide-geladen lipide nanodeeltjes correleren met behulp van kleine hoek röntgenverstrooiing, ACS Nano (2023). DOI: 10.1021/acsnano.3c01186
Tijdschrift informatie:
ACS Nano
Geleverd door Lawrence Berkeley National Laboratory