Grafisch abstract. Credit: iWetenschap (2023). DOI: 10.1016/j.isci.2023.107320
Een onderzoeksgroep onder leiding van professor emeritus Michio Homma (hij, hem) en professor Seiji Kojima (hij, hem) van de Graduate School of Science aan de Universiteit van Nagoya, in samenwerking met de Universiteit van Osaka en het Nagahama Institute of Bio-Science and Technology, hebben nieuwe inzichten in hoe voortbeweging plaatsvindt bij bacteriën.
De groep identificeerde het FliG-molecuul in de flagellaire laag, de ‘motor’ van bacteriën, en onthulde zijn rol in het organisme. Deze bevindingen suggereren manieren waarop toekomstige ingenieurs nanomachines zouden kunnen bouwen met volledige controle over hun bewegingen. Ze publiceerden het onderzoek in iWetenschap.
Naarmate nanomachines kleiner worden, halen onderzoekers inspiratie uit microscopische organismen om manieren te vinden om ze te laten bewegen en werken. In het bijzonder kan de flagellaire motor met de klok mee en tegen de klok in draaien met een snelheid van 20.000 tpm. Als hij wordt opgeschaald, zou hij vergelijkbaar zijn met een Formule 1-motor met een energieomzettingsrendement van bijna 100% en het vermogen om bij hoge snelheden onmiddellijk van draairichting te veranderen. Als ingenieurs een apparaat als een flagellaire motor zouden kunnen ontwikkelen, zou dit de manoeuvreerbaarheid en efficiëntie van nanomachines radicaal vergroten.
De flagellaire motoren in bacteriën hebben een rotor en een stationaire component eromheen, de stator. Als het flagellum deel uitmaakte van een auto, zou de stator de motor zijn. De rotatie van de stator wordt als een tandwiel op de rotor overgebracht, waardoor de rotor gaat draaien. Afhankelijk van de rotatie beweegt de bacterie voor- of achteruit, zoals een automatische auto met achteruit- en rijstanden. Een eiwitcomplex genaamd de C-ring bestuurt deze beweging.
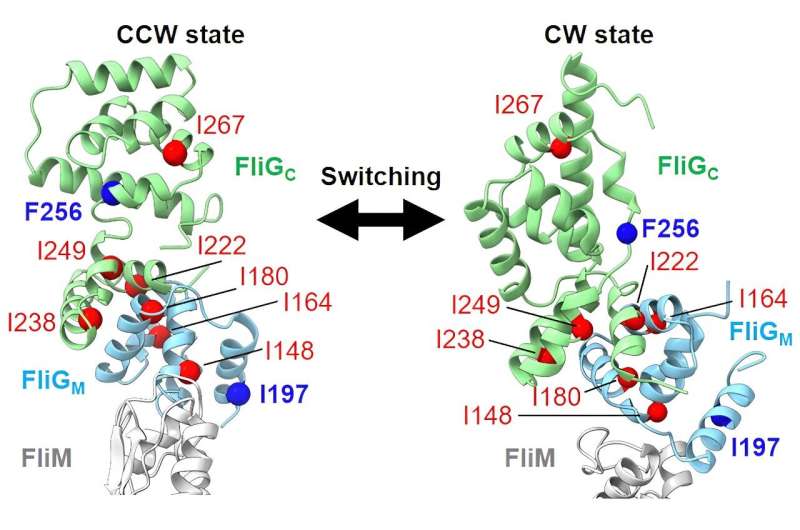
Binnen de C-ring fungeert het FliG-molecuul als de koppeling en schakelt over van voorwaartse naar achterwaartse beweging. Net als bij een auto moeten de onderdelen samenwerken. De kleinste verandering kan de motor beïnvloeden. In de flagellaire motor zijn deze kleine veranderingen mutaties. Homma’s groep bestudeerde de G215A-mutant in FliG, die een permanente rotatie van de motor met de klok mee veroorzaakt, en vergeleek deze met de niet-gemuteerde vorm die zowel voorwaarts als achterwaarts kan bewegen.
Toen ze de G215A-mutant van het mariene organisme Vibrio alginolyticus testten, ontdekten ze dat deze beweging met de klok mee het gevolg was van veranderingen in FliG en de interactie van watermoleculen rond het eiwit. Ze zagen deze veranderingen ook in de normale vorm wanneer deze met de klok mee draaide. Deze verschilden echter van de beelden die te zien waren toen het tegen de klok in draaide.
“De flagellaire motor draait in beide richtingen: met de klok mee om achteruit te gaan en tegen de klok in om vooruit te gaan”, aldus Homma. “In deze studie ontdekten we dat de structuur van FliG en de interactie van watermoleculen eromheen anders zijn wanneer de motor met de klok mee en tegen de klok in beweegt. Door dit verschil kunnen bacteriën onmiddellijk schakelen tussen voorwaartse en achterwaartse bewegingen als reactie op veranderingen in de omgeving.”
“De verduidelijking van de fysieke eigenschappen van het FliG-eiwit in motoren is een belangrijke doorbraak in ons begrip van het moleculaire mechanisme dat de draairichting van motoren verandert, wat manieren suggereert om compacte motoren te creëren met een hogere energieconversie-efficiëntie”, aldus Homma. “Met behulp van deze bevindingen zal het mogelijk zijn kunstmatige nanomachines te ontwerpen die hun rotatie vrijelijk kunnen controleren, wat naar verwachting zal worden toegepast op verschillende toekomstige gebieden, zoals de geneeskunde en het ontwerp van kunstmatig leven.”
Meer informatie:
Tatsuro Nishikino et al., Veranderingen in het hydrofobe netwerk van het FliGMC-domein veroorzaken rotatieschakeling van de flagellaire motor, iWetenschap (2023). DOI: 10.1016/j.isci.2023.107320
Tijdschriftinformatie:
iWetenschap
Geleverd door de Universiteit van Nagoya