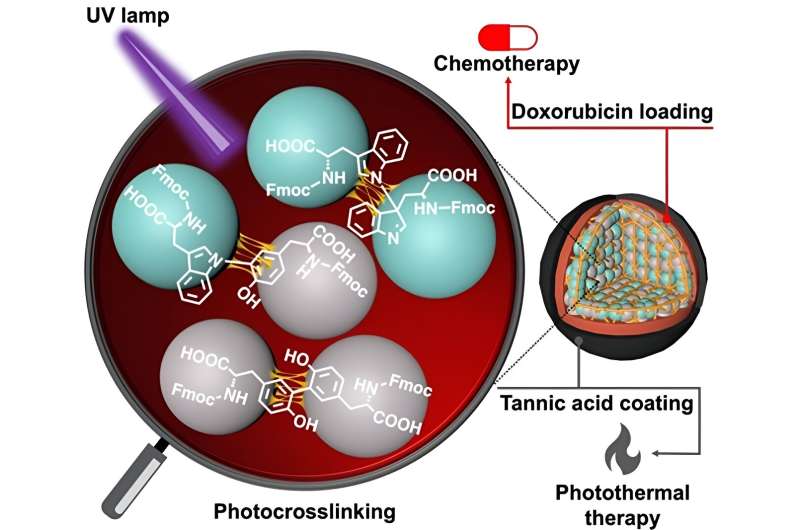
Nanotechnologie biedt de mogelijkheid om de oppervlakte-eigenschappen van nanodeeltjes aan te passen en het algehele profiel van geneesmiddelafgifte te verbeteren. Het gebruik van een looizuurcoating in combinatie met het laden van het kankerbestrijdende medicijn doxorubicine creëert een slim medicijnafgiftesysteem dat kan worden geactiveerd om het medicijn op een gecontroleerde en duurzame manier vrij te geven, wat resulteert in een verhoogde werkzaamheid tegen kanker. Krediet: Eijiro Miyako / JAIST.
Aminozuren, zoals tyrosine en tryptofaan, zijn de fundamentele bouwstenen waaruit eiwitten bestaan. Deze biomoleculen hebben verschillende chemische groepen aan elk uiteinde en zijketen, en hebben dus het natuurlijke vermogen om een keten te vormen door de vorming van een amide (peptide) binding. Dergelijke verbindingen zijn echter zwak en worden gemakkelijk afgebroken onder fysiologische omstandigheden. Dit is waar de Fmoc-beschermde aminozuren in beeld komen.
In een nieuwe studie heeft een onderzoeksteam onder leiding van Dr. Eijiro Miyako, universitair hoofddocent, Japan Advanced Institute of Science and Technology (JAIST) en Dr. Alberto Bianco en Dr. Cécilia Ménard-Moyon van het Centre National de la Recherche Scientifique ( CNRS), Frankrijk, gebruikte ultraviolet licht bij 254 nm (leidend tot CBPUV-nanodeeltjes) en riboflavine-gemedieerde verknoping bij 365 nm (leidend tot CBPRibo-nanodeeltjes) om de Fmoc-beschermde aminozuren te verknopen.
“Aminozuren zijn de bouwstenen van eiwitten en hebben talloze voordelen, zoals een betere biocompatibiliteit. Daarom wilden we nieuwe, zelf-geassembleerde, op aminozuren gebaseerde nanodeeltjes creëren die via meerdere mechanismen kunnen worden geactiveerd”, zegt Dr. Eijiro Miyako. De bevindingen van deze studie zijn gepubliceerd in Klein.
De zelf-assemblerende aminozuren waren stabiel verknoopte dimeren van Fmoc-Tyr-OH (Tyrosine) en Fmoc-Trp-OH (Tryptofaan). Doxorubicine, een medicijn tegen kanker, werd vervolgens in de verknoopte aminozuurnanodeeltjes geladen.
Om de stabiliteit van de nanodeeltjes te vergroten, gebruikten de onderzoekers een looizuur-ijzer (Fe3+) complex (of TAF) als de buitenste coatinglaag. Deze coating kan in de cellen worden afgebroken door de enzymatische afgifte van glutathion of door pH-verschillen in de micro-omgeving van de tumor. De looizuurcoating kan ook worden gebruikt bij fotothermische antikankertherapie, waarbij extern licht de lokale temperatuur rond het kankerweefsel kan verhogen, waardoor kankerceldood ontstaat.
De gesynthetiseerde nanodeeltjes werden vervolgens uitgebreid bestudeerd op hun structurele integriteit, stabiliteit en geneesmiddelafgifte onder verschillende pH-omstandigheden. Het functionele profiel, de cellulaire opname en de biocompatibiliteit van zelf-geassembleerde aminozuurnanodeeltjes werden vervolgens bestudeerd met behulp van celkweektechnieken.
Ten slotte werd de antikankereffectiviteit van gesynthetiseerde nanodeeltjes geanalyseerd in tumordragende muizen. De gecombineerde aanpak van chemotherapie, dankzij de werking van doxorubicine, en fotothermische therapie dankzij de looizuurcoating, vertoonde een uitstekende antikankeractiviteit.
Na verknoping vertoonden de op aminozuren gebaseerde nanodeeltjes opmerkelijke veranderingen in kleur, grootte, absorptie, fluorescentie en thermische stabiliteit. Bovendien vertoonde CBPUV superieure stabiliteit na verknoping, vergeleken met CBPRibo. CBPUV behield ook consequent zijn structuur, terwijl CBPRibo gedeeltelijke demontage vertoonde en holle bollen vormde.
Onderzoek naar de afgifte van geneesmiddelen bracht een minimale afgifte van geneesmiddelen aan het licht onder een fysiologische pH (7,4), wat aangeeft dat een stabiele coating cruciaal is voor in vivo afgifte. Bij pH 5,5 resulteerde onvolledige afbraak van de coating in een verwaarloosbare geneesmiddelafgifte. De toevoeging van glutathion (GSH) bij pH 5,5 verhoogde echter de geneesmiddelafgifte aanzienlijk door afbraak van de TAF-coating te veroorzaken, wat wijst op de GSH/pH-responsiviteit.
De gecombineerde zuur- en GSH-behandeling versterkte de afbraak van de coating. Dit responsieve gedrag maakt gecontroleerde medicijnafgifte onder specifieke fysiologische omstandigheden mogelijk. Bovendien onthulden in vitro beoordelingen concentratieafhankelijke cytotoxiciteit en verbeterde werkzaamheid bij gecombineerde chemo/fotothermische therapie. In vivo studies bij tumordragende muizen toonden significante remming van de tumorgroei aan, wat wijst op veelbelovende antikankereffecten zonder waargenomen bijwerkingen.
Dr. Miyako zei: “Nanotechnologie belooft de basislaboratoriumwetenschap te transformeren in een krachtig hulpmiddel voor de bestrijding van complexe ziekten zoals kanker. We zijn optimistisch dat dit baanbrekende onderzoek vooruitgang zal boeken en zich mogelijk zal ontwikkelen tot geavanceerde kankerbehandelingstechnologie, klaar voor klinische proeven binnen tien jaar. jaren.”
In de toekomst kan de ontwikkeling van deze zelf-geassembleerde aminozuurnanodeeltjes helpen bij het bestrijden van kritieke problemen zoals resistentie tegen meerdere geneesmiddelen bij kanker en het verbeteren van de algehele werkzaamheid van de behandelingsresultaten.
Meer informatie:
Tengfei Wang et al., Fotocrosslinked co-geassembleerde aminozuurnanodeeltjes voor gecontroleerde chemo/fotothermische gecombineerde antikankertherapie, Klein (2023). DOI: 10.1002/klein.202307337
Tijdschriftinformatie:
Klein
Geleverd door het Japan Advanced Institute of Science and Technology
