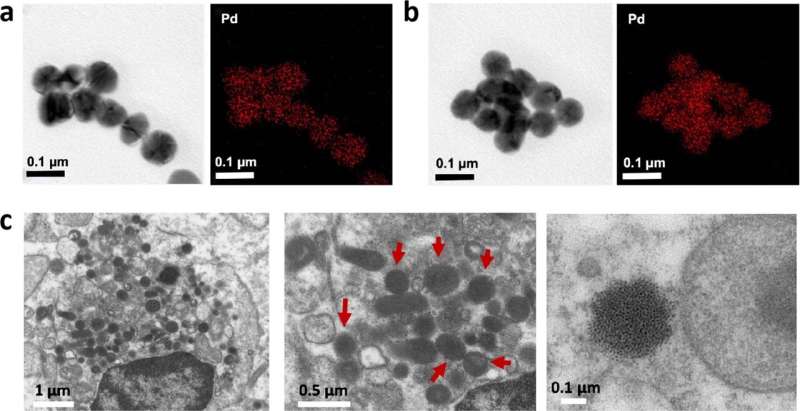
EM-beelden van PdL-nanodeeltjes gedetecteerd in DMEM, bloed en tumorplaats. ( a, b ) TEM- en EDX-elementafbeeldingen van nanodeeltjes gedetecteerd in DMEM (10% FBS) en in het bloed van muizen 5 minuten na behandeling met PdL. ( c ) EM-beelden bij verschillende vergrotingen van plakjes A375-tumoren in xenotransplantaten van muizen 12 uur na intraveneuze staartinjectie van PdL. Nanodeeltjes worden aangegeven met rode pijlen. Credit: Natuur chemie (2023). DOI: 10.1038/s41557-023-01199-w
Chemotherapie die het lichaam niet schaadt, maar effectief kankercellen bestrijdt: dat is het doel van chemicus Sylvestre Bonnet en zijn team. Tijdens zijn Ph.D. onderzoek bracht chemicus Xuequan Zhou dat doel een beetje dichterbij. Hij ontwikkelde moleculen die, na injectie in de bloedbaan, zichzelf assembleren tot nanodeeltjes die zich ophopen in de tumor. Gerichte bestraling met zichtbaar licht valt vervolgens de tumor aan. Het onderzoek is nu gepubliceerd in Natuur chemie.
“Conventionele medicijnen tegen kanker maken vaak niet genoeg onderscheid tussen goede en slechte cellen”, legt Bonnet uit. “Ze vermoorden ze allebei.” De onderzoekers hebben een oplossing voor dit probleem bedacht: nanodeeltjes die zich op de tumor richten en pas actief worden onder invloed van zichtbaar licht. “Met deze fototherapie tegen kanker kunnen artsen een specifiek deel van het lichaam behandelen zonder de rest te beschadigen. Het wordt al in verschillende ziekenhuizen gebruikt.”
Moleculen die zelf nanodeeltjes vormen
Tot nu toe moesten chemici de medicijnen voor chemotherapie eerst in het lab aan nanodeeltjes hechten. Artsen dienden ze vervolgens toe door injectie in de bloedbaan van de patiënt. Conjugatie aan de nanodeeltjes hielp de chemotherapie om de tumor te vinden. Zhou’s medicijn werkt iets anders. “Het labwerk is niet meer nodig”, zegt hij. “Je kunt de moleculen direct toedienen. Eenmaal in het bloed vormen zich vanzelf nanodeeltjes.”
En dat heeft verschillende voordelen, zegt Zhou. “Ten eerste scheelt het veel werk en voorbereidingstijd. Maar daarnaast is het ook veiliger en effectiever.” Het maken van nanodeeltjes in het lab is ingewikkeld: er ontstaat altijd een mix van deeltjes met verschillende groottes en dus verschillende eigenschappen. De samenstelling van die mix is moeilijk precies te bepalen. Je weet dus nooit 100% zeker hoe deze deeltjes zich gaan gedragen in je lichaam.
Zhou zegt: “Met een molecuul is dit eenvoudiger: als je moleculen maakt, kun je met chemische analyse bepalen of ze zuiver zijn.” Bonnet voegt eraan toe: “Als je deze moleculen vervolgens in het bloed injecteert, lijken de resulterende nanodeeltjes allemaal erg op elkaar. Dat komt omdat het lichaam die moleculen allemaal op dezelfde manier verwerkt.”
Het molecuul van Xuequan is een zogenaamd palladiumcomplex – een molecuul met een metalen kern gemaakt van palladium. Normaal gesproken is het palladiumatoom verbonden met vier stikstofatomen, maar Zhou verving twee van die stikstofatomen door koolstofatomen. Bij bestraling met groen licht krijgt het palladiumcomplex extra energie. Die extra energie zorgt ervoor dat het complex elektronen overdraagt naar de zuurstofmoleculen (O2) al aanwezig in de bestraalde cellen. Dit mechanisme creëert een reactieve zuurstofsoort die kankercellen doodt.
In 2020 maakte Zhou ook een kankermedicijn met zelfassemblerende eigenschappen. “Dit nieuwe molecuul is echter een stap verder”, zegt hij. “Door niet één maar twee koolstofatomen aan het metaal te binden, wordt het medicijn nu geactiveerd onder groen licht, in plaats van blauw.” Groen licht zorgt voor een betere penetratie in lichaamsweefsel en is daarom veel nuttiger voor therapie bij muizen. “Ons uiteindelijke doel is een medicijn dat werkt onder infrarood licht”, zegt Bonnet. “Dat licht zou een nog diepere penetratie mogelijk maken. Het zou ons in staat stellen om grotere tumoren diep in het lichaam van menselijke patiënten te bestrijden.”
Deze nieuwe studie volgde een betere, klinisch relevantere aanpak. In de eerste studie injecteerden Zhou en zijn collega’s het medicijn rechtstreeks in de tumor. “Deze keer gingen we een stap verder en keken we in muismodellen waar het medicijn in de bloedbaan werd geïnjecteerd”, zegt hij. “Zo zou het in ziekenhuizen immers ook gaan. We wilden weten of de medicijnnanodeeltjes de omstandigheden in het lichaam zouden overleven. En dat was gelukkig zo.”
Zhou’s molecuul bleek zeer effectief te zijn. “Tien procent van het toegediende medicijn bereikt de tumor”, zegt Bonnet. “Van elke 100 moleculen die we toedienen, komen er tien aan op de plaats van bestemming. Bij veel nanomedicijnen ligt dat percentage veel lager. Uit een onderzoek van enkele jaren geleden bleek dat het gemiddelde slechts 0,7% is.”
Hoe is dit precies mogelijk? Moleculen die zelf nanodeeltjes vormen? “Dat weten we zelf ook niet precies”, geeft Bonnet toe. “We weten dat palladium cruciaal is, en Xuequan ontdekte dat eiwitten in het bloed waarschijnlijk ook een rol spelen. Als die eiwitten ontbreken, blijven de nanodeeltjes groeien en worden ze zo groot dat ze uiteindelijk niet langer in oplossing blijven. Het lijkt er dus op dat de eiwitten beperken de groei van de nanodeeltjes, maar we kunnen nog niet precies zeggen hoe. We weten dat het werkt. Dat is het belangrijkste. Maar waarom het zo goed werkt? Dat moet verder onderzoek uitwijzen.”
Meer informatie:
Xue-Quan Zhou et al., In vivo metallofiele zelfassemblage van een door licht geactiveerd geneesmiddel tegen kanker, Natuur chemie (2023). DOI: 10.1038/s41557-023-01199-w
Tijdschrift informatie:
Natuur chemie
Aangeboden door de Universiteit Leiden