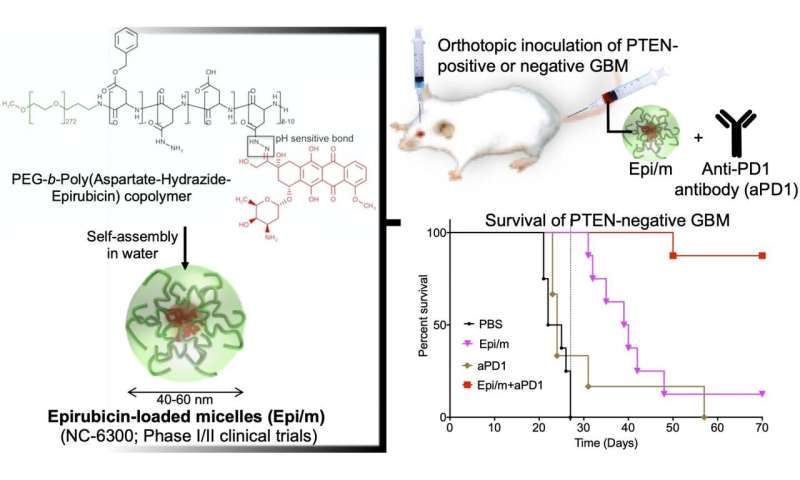
Links: hydrofoob epirubisine is geconjugeerd aan een uiteinde van de hydrofiele polyethyleenglycol (PEG) -keten met aspartaat-hydrazide als een linker. In water is dit molecuul zelf-geassembleerd tot nanomicellen (Epi / m). Rechtsboven: PTEN (+) of PTEN (-) GBM werd getransplanteerd in de hersenen van muizen, en Epi / m en anti-PD1-antilichaam (aPD1) werden via de staartader toegediend om de overlevingsperiode te evalueren. Rechtsonder: Vergelijking van overlevingsperiode in geval van PTEN (-) GBM. PBS (fosfaatbufferoplossing) werd aan de controlegroep toegediend. Dientengevolge kon geen van de controlegroepen (zwart) meer dan 30 dagen overleven (8/8). De groep met alleen Epi / m (roze) stierf geleidelijk na 30 dagen, de helft (4/8) in 40 dagen en 7/8 na 50 dagen. aPD1 alleen (bruin) doodde 6/7 binnen 30 dagen. Daarentegen stierf 1/8 met behulp van Epi / m + aPD1 (rood) 50 dagen later, maar 7/8 leefden zelfs na 3 maanden. Krediet: 2020 Innovation Center of NanoMedicine
Een op nanogeneeskunde gebaseerde strategie voor chemo-immunotherapie (CIT) van glioblastoom (GBM), die de slechtste prognose heeft onder hersentumoren, werd met succes ontwikkeld. In vivo experimenten toonden aan dat het gecombineerde gebruik van epirubicine-inkapselende nanomicellen (Epi / m) met immuuncheckpointremmers (ICI) PTEN-negatieve GBM, die in hoge mate resistent is tegen ICI alleen, heeft uitgeroeid. Vanwege de synergetische effecten van de combinatie Epi / m plus ICI, nam het aantal tumor-infiltrerende T-cellen (TIL) en andere antitumor immuuncellen significant toe om kankercellen effectief te doden.
Aan de andere kant waren intratumorale van beenmerg afgeleide immunosuppressieve cellen (MDSC), die de immuunrespons verstoren, significant verminderd. Het CIT zorgde ook voor robuuste immunologische geheugeneffecten tegen de tumoren, die effectief nieuw geïmplanteerde PTEN-negatieve GBM-cellen in de hersenen afstoten. Hoewel vrij epirubicine schade kan toebrengen aan organen, met name hematopoëtische organen, heeft onze nanogeneeskunde-strategie deze bijwerkingen aanzienlijk verminderd en de immuunrespons verbeterd. Epi / m is al gevorderd in klinische proeven voor andere kankertypes, en naar verwachting zal deze CIT-strategie in de toekomst worden vertaald naar klinische evaluatie. Deze resultaten zijn gepubliceerd in ACS Nano op 6 augustus door de American Chemical Society.
Het Innovation Center of Nanomedicine (directeur: prof.Kazunori Kataoka, locatie: Kawasaki-City, afkorting: iCONM) kondigde aan dat een nieuwe therapeutische optie voor glioblastoom (GBM) werd gedemonstreerd bij muizen, in een samenwerkingsstudie met het Department of Bioengineering, Graduate School of Engineering, The University of Tokyo. GBM is een hersentumor met extreem snelle progressie en slechte prognose (5-jaars overlevingspercentage: 10,1%). Hoewel verschillende verbindingen worden geëvalueerd in klinische onderzoeken, is er geen therapeutische optie om de overlevingsperiode significant te verbeteren. Met name patiënten met afwijkingen in het PTEN-gen, een van de kankeronderdrukkende genen, zijn zeer resistent tegen de momenteel beschikbare therapieën en hebben hoge medische behoeften.
In het algemeen wordt aangenomen dat immuuncontrolepuntremmers (ICI’s) ineffectief zijn tegen GBM, aangezien GBM immunosuppressief is bij lage T-celinfiltratie. In de methode die in dit artikel wordt gepresenteerd, maakt de iCONM-technologie voor het toedienen van nanodrugs selectieve tumoraccumulatie van epirubicine, dat immunogene celdood (ICD) veroorzaakt, naar tumorweefsel, waardoor ICD lokaal synergetisch met ICI wordt veroorzaakt. Als gevolg hiervan was deze op nanogeneeskunde gebaseerde chemo-immunotherapie (CIT) effectief bij muizen die met GBM in de hersenen waren getransplanteerd (hierna muis GBM-model genoemd), en slaagde erin de overleving van muizen aanzienlijk te verlengen. De combinatie van de met epirubicine beladen met nanomicellen behandelde muizen vertoonde een hoge infiltratie van cytotoxische T-cellen (TIL) en verminderde uit beenmerg afkomstige immunosuppressieve cellen (MDSC). Uiteindelijk werd onderdrukking van de immuuncontrolepuntfunctie waargenomen.
Mutaties in het PTEN-gen komen vaak voor in GBM, wat resulteert in immunosuppressieve routes die de resistentie tegen ICI’s bevorderen. Dus, terwijl ICI’s 40% van de tumoren uitroeiden in een muizen-GBM-model waarin het PTEN-gen normaal is, in een model waarin het PTEN-gen werd uitgeschakeld, konden ICI’s de overleving van muizen niet verlengen. Op cellulair niveau werd gevonden dat PTEN-deficiënte cellen (CT2A-luc) ongeveer 5 keer meer PDL1 tot expressie brachten dan dat van normale cellen, wat waarschijnlijk verband houdt met de therapeutische resistentie met ICI. Aangezien epirubicine het vermogen heeft getoond om PDL1-expressie in tumoren, zoals borstkanker, te onderdrukken, zou het mogelijk zijn om PDL1-spiegels van GBM te verlagen als er voldoende epirubicine in GBM-laesies kan worden afgegeven. Zo werd CIT met behulp van nanomicellen die epirubicine (Epi / m) bevatten in combinatie met ICI gebruikt om de antitumorale werkzaamheid tegen GBM te verbeteren.
In een GBM-model met normale PTEN-expressie (GL261-luc), resulteerden Epi / m (5 mg / kg op Epi-basis) plus anti-PD1-antilichamen (5 mg / kg) in de overleving van alle muizen gedurende meer dan 70 dagen, met een opmerkelijke verlenging van de overlevingstijd. In dit model stierven met PBS behandelde muizen binnen 30 dagen, muizen behandeld met alleen anti-PD1-antilichamen (5 mg / kg) lieten 40% van de muizen ten minste 70 dagen overleven en Epi / m (5 mg / kg Epi-basis) resulteerde in een overleving van 80% van de muizen gedurende meer dan 70 dagen. Daarentegen resulteerden in het PTEN-deficiënte model (CT2A-luc), Epi / m (5 mg / kg op Epi-basis) plus anti-PD1-antilichamen (5 mg / kg) in slechts 30% van de muizen overleving gedurende meer dan 70 dagen, en voor de andere controlegroepen kon geen duidelijk overlevingseffect worden bevestigd. Toen de dosis werd verhoogd tot 15 mg / kg Epi / m (op Epi-basis) en gecombineerd met anti-PD1-antilichamen (5 mg / kg), kon 90% van de muizen meer dan 70 dagen overleven, wat de muizen opmerkelijk verlengde. overleving.
Hiroaki Kinoh et al, Translationele Nanomedicine verhoogt de anti-PD1-therapie om orthotopisch PTEN-negatief glioblastoom uit te roeien, ACS Nano (2020). DOI: 10.1021 / acsnano.0c03386
ACS Nano
Geleverd door Innovation Center of NanoMedicine