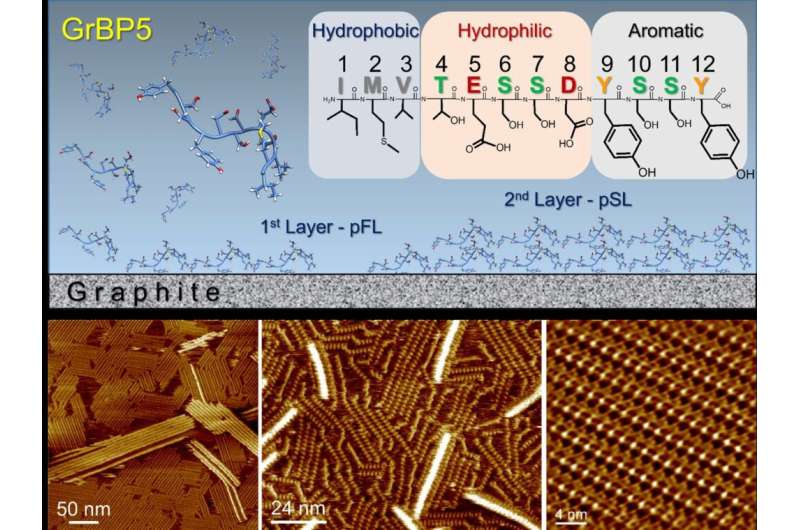
Het grafietbindende peptide en oppervlakteverschijnselen. De aminozuursequentie van het dodecapeptide vertoont drie chemisch verschillende domeinen en een schematische weergave van de mogelijke oppervlakteverschijnselen. Moleculaire resolutie AFM-afbeeldingen van zelf-geassembleerde peptide-nanostructuren, verkregen in water. Credit: ACS Nano (2023). DOI: 10.1021/acsnano.2c10673
In een studie die onlangs in het tijdschrift is gepubliceerd ACS Nanogebruikten onderzoekers van Kanazawa University, Kanazawa, Japan, in samenwerking met University of Washington, Seattle, VS, frequentie-gemoduleerde atoomkrachtmicroscopie om de moleculaire architectuur van een genetisch ontworpen peptide en zijn zelforganisatie die dikke kristallen van één molecuul vormt op atomair vlakke grafietoppervlakken, die een potentieel platform bieden voor hybride technologieën zoals bio-elektronica, biosensoren en eiwitarrays.
Net als een eiwit heeft een peptide ook een keten van natuurlijke aminozuren, maar deze is veel korter, laten we zeggen 10-30 eenheden, vergeleken met die in eiwitten, die honderden of duizenden eenheden lang kunnen zijn. Samen met DNA (genetische code), polysacchariden (suikers) en lipiden (vetten) zijn eiwitten de vierde grote bouwstenen die het leven levensvatbaar maken. Eiwitten verzamelen ionen en transporteren ze, voeren enzymatische functies uit en vormen de belangrijkste structuren van de cellen.
Eiwitten zijn daarom de belangrijkste bouwstenen van organismen die de functies van het leven uitvoeren, waardoor het dynamisch wordt. Al tientallen jaren proberen wetenschappers te begrijpen hoe de volgorde van aminozuren in eiwitten is gecorreleerd met hun moleculaire architectuur, zodat men hun specifieke functies kan voorspellen. Het begrijpen van de vorm en functie van het eiwit is cruciaal om de oorsprong van ziekten te ontdekken en vaccins en medicijnen te ontwerpen.
Eiwitten kunnen ook nuttig zijn voor technologische toepassingen zoals weefselmanipulatie en het ontwerpen van biosensoren voor diagnostiek. Tot nu toe was het echter ongrijpbaar om de structuur van eiwitten te voorspellen, zelfs met behulp van de recent ontwikkelde rekenmodellen zoals Alpha-Fold, gebaseerd op de deep learning-algoritmen van Google. Het gebruik van eiwitten is daarom nog steeds niet praktisch vanwege hun enorme omvang en onvoorspelbare functies.
Peptiden daarentegen zijn kleinere versies van eiwitten met vergelijkbare rollen en zijn daarom praktischer omdat hun rollen ook afhankelijk zijn van de aminozuursequenties die tot hun vouwpatronen leiden. Vanwege hun kleinere afmetingen en ongeordende moleculaire structuren, werden peptiden jarenlang als niet zo bruikbaar beschouwd vanwege hun onvoorspelbare functies.
De “slappe” structuren van peptiden zouden echter in een voordeel kunnen worden omgezet als deze kleine biomoleculen zouden kunnen worden ontwikkeld met behulp van een interdisciplinaire benadering, waarbij biologie, engineering en voorspellende modellering worden gecombineerd. Dit is precies wat een team van wetenschappers, geleid door Ayhan Yurtsever, Linhao Sun, Kaito Hirata en Takeshi Fukuma aan de Kanazawa University en hun collega’s, Mehmet Sarikaya, een materiaalwetenschapper, en zijn team aan de University of Washington, hebben bereikt.
Door de expertise van het Seattle-Team op het gebied van genetische manipulatie te combineren bij het ontwerpen van peptiden die exclusieve affiniteit hebben met technologische vaste stoffen en de expertise van het Kanazawa-Team op het gebied van moleculaire beeldvorming onder biologisch goedaardige omstandigheden, hebben de wetenschappers de zelforganisatie van de peptiden op een vast oppervlak aangetoond en ze gevisualiseerd op ongekende moleculaire resolutie, de kennis is essentieel bij het ontwerpen van hybride biomoleculaire nanodevices voor gebruik in zowel de biologie als de technologie.
De wetenschappers bereikten deze prestatie door hun expertise in hun respectieve vakgebieden te combineren. De gebruikte peptiden werden geselecteerd door een ingenieuze benadering, genaamd gerichte evolutie, normaal gesproken gebruikt voor het selecteren van kankergeneesmiddelen voor een specifieke tumor door moleculair biologen. In dit geval werd het gebruikte molecuul, genaamd grafietbindend peptide, genetisch geselecteerd met behulp van grafiet als substraat, door een materiaalwetenschapper.
Gewapend met de expertise die is opgedaan bij het onderzoeken van moleculaire architecturen in waterige oplossingen, demonstreerde het Kanazawa-team de manier waarop het peptide zichzelf organiseert op atomair vlak grafietoppervlak in patronen, voorspeld door computationele modellering van de peptiden.
Wetende dat de manier waarop de eiwitten hun functie uitvoeren, is door moleculaire herkenning van hun biologische substraten (bijvoorbeeld DNA, eiwitten, enzymen, andere biomoleculen of zieke cellen), realiseerden de wetenschappers zich dat de peptiden zich voorspelbaar zelforganiseren op grafiet, een synthetisch substraat, vanwege hetzelfde moleculaire herkenningsprincipe als in de biologie.
De oorsprong van moleculaire herkenning en de controle ervan via het ontwerpen van een nieuwe aminozuursequentie is de heilige graal in de biologie, want als het proces kan worden gecontroleerd, kunnen vele soorten medicijnen en vaccins worden ontworpen op basis van het doelwit (zieke) molecuul of de substraat. Hier is het doelwit een technologisch materiaal, grafiet, of het kan ook grafeen zijn, de versie met één atoomlaag, een zeer belangrijk technologisch materiaal van de laatste twee decennia.
In dit werk hebben de samenwerkingsteams van Kanazawa en Seattle ontdekt dat het grafietbindende peptide niet alleen het atoomrooster van grafiet herkent, maar ook zijn eigen moleculaire kristal vormt, waardoor een coherente, continue, zachte interface tussen het peptide en de vaste stof tot stand komt.
“Het vermogen om biologie naadloos te overbruggen met functionele vaste stoffen op moleculair niveau is de cruciale eerste stap naar het creëren van op biologie geïnspireerde technologieën en zal zich waarschijnlijk lenen voor het ontwerp van biosensoren, bio-elektronica en op peptiden gebaseerde biomoleculaire arrays, en zelfs logische apparaten. , allemaal hybride technologieën van de toekomst”, zeggen de wetenschappers.
De teams zijn momenteel druk bezig met het uitbreiden van hun ontdekking bij het aanpakken van verdere vragen, zoals de effecten van mutaties, gestructureerd water rond peptiden, op andere vaste substraten, en fysieke experimenten over de peptide-grafiet-interfaces om de stevige wetenschappelijke basis te leggen voor de ontwikkeling van de volgende generatie op biologie geïnspireerde technologieën.
Meer informatie:
Ayhan Yurtsever et al, Structuur op moleculaire schaal en kinetiek van laag-voor-laag zelforganisatie van peptiden op atomair vlakke vaste oppervlakken, ACS Nano (2023). DOI: 10.1021/acsnano.2c10673
Tijdschrift informatie:
ACS Nano
Aangeboden door de Kanazawa-universiteit