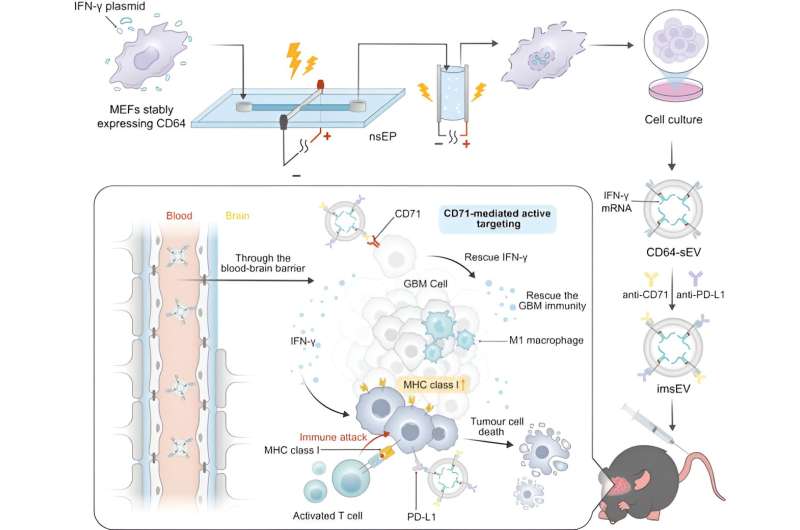
Schematische weergave van grootschalige productie en therapeutische mechanismen van imsEV. Als mRNA-afleveringsplatform werd imsEV gegenereerd met behulp van een nanoseconde-elektroporatie (nsEP)-systeem en tegelijkertijd geladen met anti-CD71-, anti-PD-L1- en IFN-γ-mRNA voor GBM-behandeling. Credit: Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-42365-5
Een team van onderzoekers van het MD Anderson Cancer Center van de Universiteit van Texas heeft een nieuwe methode ontwikkeld voor het gebruik van extracellulaire blaasjes om de reacties op immunotherapie bij glioblastoom te verbeteren, wat mogelijk de deur opent voor een breder gebruik van engineered messenger RNA (mRNA) voor kankertherapie. Het onderzoek is vandaag gepubliceerd in Natuurcommunicatie.
Eerder dit jaar ontwikkelde een team van onderzoekers onder leiding van Betty Kim, MD, Ph.D., en Wen Jiang, MD, Ph.D., een nieuwe methode voor het laden van mRNA in extracellulaire blaasjes, kleine structuren gecreëerd door cellen om biomoleculen te transporteren. en nucleïnezuren in het lichaam. De huidige studie bouwt voort op dat onderzoek door het antitumorpotentieel van met mRNA beladen extracellulaire blaasjes aan te tonen.
mRNA-therapieën, die in 2023 werden erkend door de Nobelprijs voor de Fysiologie of Geneeskunde, hebben al lang een doorbraakpotentieel op het gebied van pathogene infecties en ziekten zoals kanker. Er blijven echter uitdagingen bestaan om mRNA nauwkeurig door het hele lichaam af te leveren. Jarenlang hebben wetenschappers potentiële afgiftemechanismen bestudeerd, waaronder lipide- of polymere nanodeeltjes, maar elk van deze heeft zijn eigen beperkingen.
“Er zijn twee primaire uitdagingen bij het gebruik van mRNA-therapieën voor de behandeling van kanker. Ten eerste, hoe richt je je nauwkeurig op de tumorcellen in het lichaam? Ten tweede, hoe produceer je voldoende van de therapie voor menselijk gebruik?” zei Jiang. “Onze aanpak lost deze twee problemen op.”
Het kwantiteitsprobleem wordt opgelost door een systeem met hoge doorvoer te gebruiken om met mRNA geladen extracellulaire blaasjes uit gemanipuleerde cellen te produceren. Gastheercellen en een designerplasmide dat codeert voor het mRNA worden onderworpen aan twee extreem korte elektrische pulsen, waardoor membranen in de cel, en ook het celmembraan zelf, tijdelijk permeabel worden. Dit leidt ertoe dat de cellen veel extracellulaire blaasjes afscheiden die zijn geladen met mRNA-materiaal en die vervolgens kunnen worden verzameld.
Voor deze studie hebben de onderzoekers de extracellulaire blaasjes zo ontworpen dat ze het CD64-eiwit op hun oppervlak tot expressie brengen, wat dient als een koppelingsmechanisme om zowel anti-CD71- als anti-PD-L1-antilichamen te laden. Eenmaal in het lichaam gaan ze op zoek naar CD71 en PD-L1, die beide vaak tot overexpressie komen bij glioblastomen.
Deze extracellulaire blaasjes waren geladen met mRNA dat codeert voor interferon-gamma, een immuunsignaleringseiwit. Wanneer de blaasjes zich binden aan receptoren op tumorcellen, worden ze geïnternaliseerd en geven ze het mRNA vrij.
Eén reden waarom glioblastoom moeilijk te behandelen is, is dat de downregulatie van MHC-1, evenals andere kenmerken van de micro-omgeving van de tumor, een immunosuppressieve omgeving creëren die detectie ontwijkt en de effectiviteit van immuuntherapieën beperkt. Het mRNA keert dat om, waardoor de micro-omgeving van de tumor verandert, zodat de tumor detecteerbaar wordt voor het immuunsysteem en beter reageert op immuuntherapieën. In de preklinische modellen werd binnen 7 dagen na injectie een significante toename in overlevingstijd en initiële antitumoractiviteit waargenomen.
“We kozen voor glioblastoom omdat het momenteel beperkte behandelingsopties heeft”, zei Jiang. “We weten dat interferon-gamma reacties op immunotherapie bij glioblastomen kan induceren, maar het afleveren ervan aan de tumorcellen is tot nu toe een grote uitdaging gebleken vanwege de halfwaardetijd en het onvermogen van de meeste toedieningssystemen om de bloed-hersenen te passeren. Hopelijk maken deze resultaten de weg vrij voor het gebruik van mRNA-geladen extracellulaire blaasjes in kankertoepassingen.”
Volgens Jiang is een van de andere voordelen van deze aanpak dat het plug-and-play is, wat betekent dat het kan worden aangepast aan andere tumoren door simpelweg de antilichamen te veranderen, zodat ze zich richten op de antilichamen die tot overexpressie komen in andere tumortypen.
Verder preklinisch werk is gaande om de productiemethoden te blijven verbeteren en de veiligheid van extracellulaire blaasjes te profileren voordat ze in klinische omgevingen worden toegepast.
Meer informatie:
Shiyan Dong et al., Adaptief ontwerp van met mRNA geladen extracellulaire blaasjes voor gerichte immunotherapie van kanker, Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-42365-5
Tijdschriftinformatie:
Natuurcommunicatie
Aangeboden door het MD Anderson Cancer Center van de Universiteit van Texas