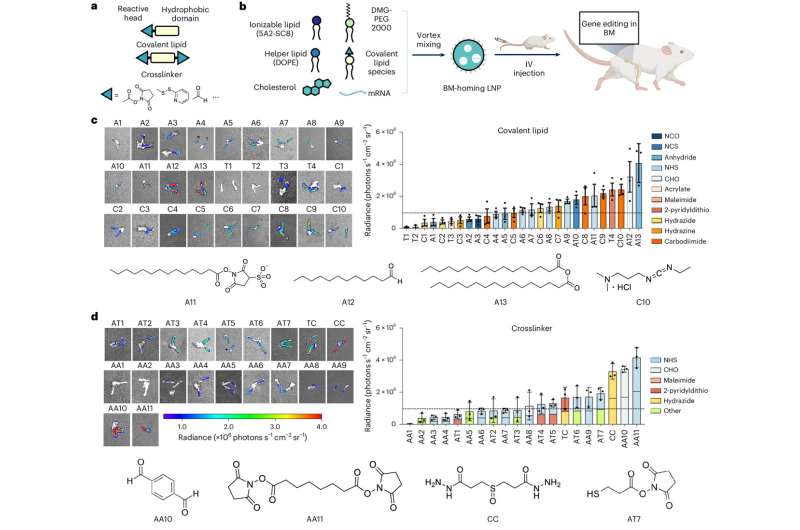
Ontdekking en ontwikkeling van BM-homing LNP’s. a, Schematische weergave van LNP-bereiding inclusief covalente lipidespecies (covalente lipiden en crosslinkers). b, Toevoeging van een covalente lipide of crosslinker aan de base-4-lipide LNP-formulering leidt tot BM mRNA-afgifte en genoombewerking in een breed scala aan unieke BM-celtypen. c,d, Bioluminescentiebeelden van gedissecteerde dijbenen en samenvatting van de gemiddelde intensiteit van het bioluminescentiesignaal op gedissecteerde dijbenen, weergegeven voor moleculaire structuren van covalente lipide (c) en crosslinker (d). Credit: Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01680-8
Huidige gentherapieën om sikkelcelziekte te behandelen zijn complex, tijdrovend en worden soms in verband gebracht met ernstige bijwerkingen zoals onvruchtbaarheid of bloedkanker. Om deze uitdagingen aan te pakken, hebben onderzoekers van Johns Hopkins speciale nanodeeltjes ontwikkeld die genbehandeling rechtstreeks naar verschillende soorten cellen in het beenmerg kunnen sturen om de ziekteveroorzakende mutaties te corrigeren.
“Deze genbewerkingsmethode zou het mogelijk maken dat patiënten het medicijn via een transfusie toegediend krijgen”, aldus Xizhen Lian, hoofdonderzoeker van de studie en assistent-onderzoeker verbonden aan het Institute for NanoBioTechnology van de Johns Hopkins Whiting School of Engineering en de Johns Hopkins School of Medicine.
“Hiermee wordt het langdurige en moeilijke proces van veel huidige gentherapieën vermeden. Hierdoor wordt de belasting voor patiënten en het zorgstelsel verminderd en worden de bijwerkingen van de behandeling tot een minimum beperkt.”
Hun resultaten zijn gepubliceerd in Natuur Nanotechnologie.
Het onderzoeksteam, dat bestond uit wetenschappers van het University of Texas Southwestern Medical Center, St. Jude Children’s Research Hospital, Harvard University en Johns Hopkins School of Medicine, gebruikte CRISPR/Cas en base-gene-editingtechnieken in een muismodel van sikkelcelziekte om een vorm van hemoglobine te activeren en de sikkelcelmutatie te corrigeren. Het team vond de aanpak ook effectief bij het targeten van leukemiecellen.
“Een uitdaging die we tegenkwamen, is dat de stamcelpopulatie erg klein is; slechts 0,1% van de cellen in het beenmerg zijn stamcellen. Ze worden ook beschermd in een micro-omgeving die de toediening van medicijnen uit de circulatie kan voorkomen,” zei Lian.
Het team loste dit probleem op door een speciaal vetmolecuul toe te voegen aan hun kleine afleveringsdeeltjes. Dit nieuwe molecuul hielp de afleveringsdeeltjes om de stamcellen te vinden en zich er sterk aan te hechten, wat belangrijke gentherapie opleverde.
De volgende stap van het team is om deze technologie te optimaliseren op een gehumaniseerd diermodel dat klinische scenario’s beter kan nabootsen, aangezien ze momenteel alleen werken met bloedcellen en componenten van knaagdieren. Gehumaniseerde diermodellen zijn genetisch gemodificeerd om menselijke genen, cellen en eiwitten tot expressie te brengen, waardoor onderzoekers menselijke ziektes kunnen bestuderen in een levend systeem dat sterk lijkt op dat van mensen.
“Onze aanpak belooft patiënten te helpen invasieve behandelingsprocedures te vermijden, wat de bijwerkingen van bloedkanker aanzienlijk zal verminderen omdat er geen willekeurige geninvoeging in de genen van de patiënt plaatsvindt. We richten ons op een specifiek gen dat de ziekte veroorzaakt en dat is alles,” zei Lian. “De enige manier om dergelijke genetische ziekten te genezen, is door de genetische mutatie in de stamcelpopulaties te corrigeren.”
Meer informatie:
Xizhen Lian et al, Lipide-nanodeeltjes die zich naar het beenmerg verplaatsen voor genoombewerking in zieke en kwaadaardige hematopoëtische stamcellen, Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01680-8
Informatie over het tijdschrift:
Natuur Nanotechnologie
Aangeboden door Johns Hopkins University