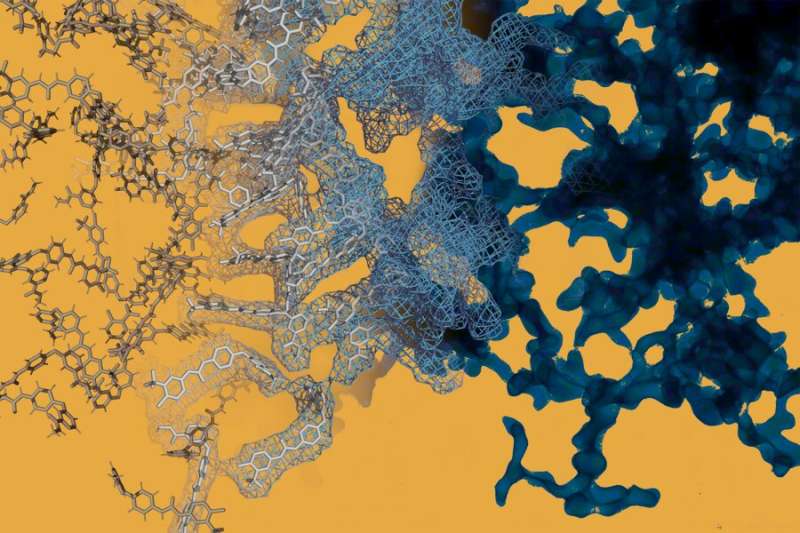
Een simulatie van moleculaire dynamica (links) wordt naast een beeld van een elektronenmicroscopie (rechts) van het kankermedicijn sorafenib geplaatst. Sorafenib kan, net als veel andere geneesmiddelen met kleine moleculen, spontaan ingewikkelde structuren op nanoschaal vormen die het gedrag van het medicijn veranderen. Krediet: Daniel Reker
Therapieën met kleine moleculen behandelen een breed scala aan ziekten, maar hun effectiviteit wordt vaak verminderd vanwege hun farmacokinetiek – wat het lichaam doet met een medicijn. Na toediening bepaalt het lichaam hoeveel van het medicijn wordt opgenomen, in welke organen het medicijn terechtkomt en hoe snel het lichaam het medicijn metaboliseert en weer uitscheidt.
Nanodeeltjes, meestal gemaakt van lipiden, polymeren of beide, kunnen de farmacokinetiek verbeteren, maar ze kunnen complex zijn om te produceren en bevatten vaak heel weinig van het medicijn.
Van sommige combinaties van kankermedicijnen met kleine moleculen en twee kleurstoffen met kleine moleculen is aangetoond dat ze zichzelf assembleren tot nanodeeltjes met extreem hoge ladingen medicijnen, maar het is moeilijk te voorspellen welke partners van kleine moleculen nanodeeltjes zullen vormen tussen de miljoenen mogelijke paren. .
MIT-onderzoekers hebben een screeningplatform ontwikkeld dat machine learning combineert met high-throughput experimenten om zelfassemblerende nanodeeltjes snel te identificeren. In een studie gepubliceerd in Natuur Nanotechnologie, onderzochten onderzoekers 2,1 miljoen paren van kleine-moleculaire medicijnen en “inactieve” medicijningrediënten, waarbij ze 100 nieuwe nanodeeltjes identificeerden met mogelijke toepassingen zoals de behandeling van kanker, astma, malaria en virale en schimmelinfecties.
“We hebben eerder enkele van de negatieve en positieve effecten beschreven die inactieve ingrediënten op medicijnen kunnen hebben, en hier beschrijven we, door een gecoördineerde samenwerking tussen onze laboratoria en kernfaciliteiten, een benadering die zich richt op de potentiële positieve effecten die deze kunnen hebben op nanovorming,” zegt Giovanni Traverso, de Karl Van Tassel (1925) Career Development Professor of Mechanical Engineering, en senior corresponderende auteur van de studie.
Hun bevindingen wijzen op een strategie die zowel de complexiteit van het produceren van nanodeeltjes oplost als de moeilijkheid om er grote hoeveelheden medicijnen op te laden.
“Zoveel medicijnen die er zijn, komen niet tot hun recht vanwege onvoldoende doelgerichtheid, lage biologische beschikbaarheid of snel metabolisme van geneesmiddelen”, zegt Daniel Reker, hoofdauteur van de studie en voormalig postdoc in het laboratorium van Robert Langer. “Door te werken op het snijvlak van datawetenschap, machine learning en medicijnafgifte, hopen we onze toolset snel uit te breiden om ervoor te zorgen dat een medicijn op de juiste plek terechtkomt en een mens daadwerkelijk kan behandelen en helpen.”
Langer, de David H. Koch Institute Professor aan het MIT en lid van het Koch Institute for Integrative Cancer Research, is ook een senior auteur van het artikel.
Een kankertherapie ontmoet zijn match
Om een machine learning-algoritme te ontwikkelen dat in staat is om zelfassemblerende nanodeeltjes te identificeren, moesten onderzoekers eerst een dataset bouwen waarop het algoritme kon trainen. Ze selecteerden 16 zelfaggregerende geneesmiddelen met kleine moleculen met een verscheidenheid aan chemische structuren en therapeutische toepassingen en een diverse reeks van 90 algemeen verkrijgbare verbindingen, waaronder ingrediënten die al aan geneesmiddelen zijn toegevoegd om ze beter te laten smaken, langer te laten duren of langer te maken. stal. Omdat zowel de medicijnen als de inactieve ingrediënten al door de FDA zijn goedgekeurd, zijn de resulterende nanodeeltjes waarschijnlijk veiliger en gaan ze sneller door het goedkeuringsproces van de FDA.
Het team testte vervolgens elke combinatie van een klein molecuul medicijn en een inactief ingrediënt, mogelijk gemaakt door het Swanson Biotechnology Center, een reeks kernfaciliteiten die geavanceerde technische diensten leveren binnen het Koch Institute. Na het mengen van paren en het laden van 384 monsters per keer op nanowellplaten met behulp van robotica in de High Throughput Sciences-kern, liepen onderzoekers over de platen, vaak met snel afbrekende monsters, naast de Peterson (1957) Nanotechnology Materials Core Facility-kern om de grootte te meten van deeltjes met dynamische lichtverstrooiing met hoge doorvoer.
Nu getraind op 1.440 datapunten (met 94 nanodeeltjes al geïdentificeerd), zou het machine learning-platform kunnen worden ingeschakeld voor een veel grotere bibliotheek met verbindingen. Door 788 kleinmoleculaire geneesmiddelen te screenen tegen meer dan 2.600 inactieve geneesmiddelingrediënten, identificeerde het platform 38.464 potentiële zelfassemblerende nanodeeltjes uit 2,1 miljoen mogelijke combinaties.
De onderzoekers selecteerden zes nanodeeltjes voor verdere validatie, waaronder een bestaande uit sorafenib, een behandeling die vaak wordt gebruikt voor gevorderde lever- en andere kankers, en glycyrrhizine, een verbinding die vaak wordt gebruikt als voedings- en medicijnadditief en het meest bekend als zoethoutsmaak. Hoewel sorafenib de standaardbehandeling is voor gevorderde leverkanker, is de effectiviteit ervan beperkt.
In celculturen van menselijke leverkankers werkten de sorafenib-glycyrrhizine-nanodeeltjes twee keer zo goed als sorafenib alleen omdat meer van het medicijn de cellen kon binnendringen. In samenwerking met de preklinische modellering, beeldvorming en testfaciliteit van het Koch Institute, behandelden onderzoekers muismodellen van leverkanker om de effecten van sorafenib-glycyrrhizine-nanodeeltjes te vergelijken met beide verbindingen op zichzelf. Ze ontdekten dat het nanodeeltje de niveaus van een marker geassocieerd met progressie van leverkanker significant verlaagde in vergelijking met muizen die sorafenib alleen kregen, en langer leefden dan muizen die alleen sorafenib of glycyrrhizine kregen. Het sorafenib-glycyrrhizine-nanodeeltje vertoonde ook een betere gerichtheid op de lever in vergelijking met orale toediening van sorafenib, de huidige standaard in de kliniek, of bij het injecteren van sorafenib nadat het is gecombineerd met cremophor, een veelgebruikte medicijnvehikel dat de oplosbaarheid in water verbetert, maar heeft giftige bijwerkingen.
Gepersonaliseerde medicijnafgifte
Het nieuwe platform kan nuttige toepassingen hebben die verder gaan dan het optimaliseren van de efficiëntie van actieve geneesmiddelen: het zou kunnen worden gebruikt om inactieve verbindingen aan te passen aan de behoeften van individuele patiënten. In eerder werk ontdekten leden van het team dat inactieve ingrediënten bij sommige patiënten ongewenste allergische reacties konden veroorzaken. Met de uitgebreide toolbox voor machine learning kunnen nu meer opties worden gegenereerd om deze patiënten alternatieven te bieden.
“We hebben de kans om na te denken over het afstemmen van het toedieningssysteem op de patiënt”, legt Reker uit, nu assistent-professor biomedische technologie aan de Duke University. “We kunnen zaken als geneesmiddelabsorptie, genetica en zelfs allergieën verklaren om bijwerkingen bij de bevalling te verminderen. Wat de mutatie of medische aandoening ook is, het juiste medicijn is alleen het juiste medicijn als het echt werkt voor de patiënt.”
De tools voor veilige, effectieve medicijnafgifte bestaan, maar het samenvoegen van alle ingrediënten kan een langzaam proces zijn. De combinatie van machine learning, snelle screening en het vermogen om interacties tussen verschillende combinaties van materialen te voorspellen, zal het ontwerp van medicijnen en de nanodeeltjes die worden gebruikt om ze door het lichaam af te geven, versnellen.
Bij de lopende werkzaamheden probeert het team niet alleen de effectieve afgifte van medicijnen te verbeteren, maar ook naar mogelijkheden om medicijnen te maken voor mensen voor wie standaardformuleringen geen goede optie zijn, door big data te gebruiken om problemen in kleine populaties op te lossen door naar de genetische geschiedenis te kijken, allergieën en voedselreacties.
Daniel Reker et al. Computationeel geleid high-throughput ontwerp van zelfassemblerende medicijnnanodeeltjes, Natuur Nanotechnologie (2021). DOI: 10.1038 / s41565-021-00870-y
Natuur Nanotechnologie
Geleverd door Massachusetts Institute of Technology