Kinderarts Erica Esrick bespreekt bestaande sikkelcelbehandelingen en een lopend klinisch onderzoek

Erica Esrick (uiterst rechts) praat met Helen Obando, een patiënt in een gentherapieproef voor sikkelcelziekte, en haar familie in 2019.
Tegenwoordig is het duidelijk dat onze genen niet alleen veel ziekten veroorzaken, maar ook potentiële genezingen bevatten. Maar dat was niet altijd het geval. Pas in 1949 vonden wetenschappers voor het eerst de moleculaire boosdoener van een ziekte – de wortels ervan in de genetische code. De ziekte was de bloedziekte die bekend staat als sikkelcelziekte, een erfelijke aandoening die ernstige en slopende pijn veroorzaakt. Nu, bijna 75 jaar later, ontwikkelen onderzoekers gentherapieën om het te genezen.
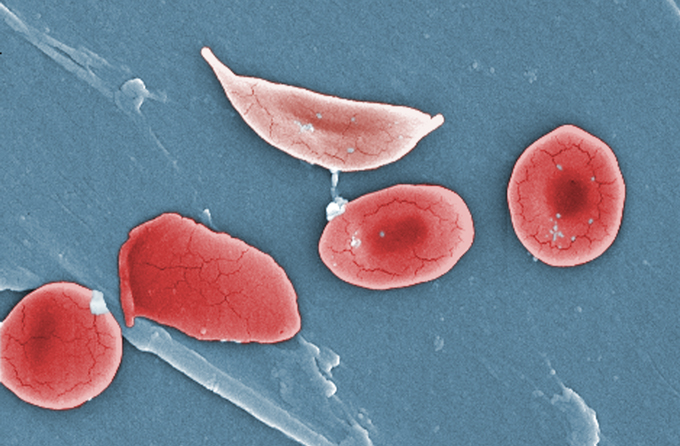
Sikkelcelziekte is het gevolg van een verandering in een sleuteleiwit in hemoglobine, dat helpt bij het transport van zuurstof in rode bloedcellen. Hemoglobine zorgt er normaal gesproken voor dat “rode bloedcellen erg slap en buigzaam zijn en gemakkelijk door de bloedvaten glijden en glijden”, zegt kinderarts Erica Esrick. Maar een mutatie in een enkel gen, de HBB gen, zorgt ervoor dat hemoglobine in lange strengen in bloedcellen wordt gestapeld, waardoor ze een onbuigzame, sikkelvorm krijgen. In plaats van “squishy” te zijn, komen de stijve rode bloedcellen vast te zitten in bloedvaten, waardoor de bloedstroom wordt geblokkeerd.
Sikkelcelziekte treft miljoenen mensen over de hele wereld, vooral degenen wier voorouders afkomstig zijn uit Afrika bezuiden de Sahara, delen van het Midden-Oosten en Zuidoost-Azië. In de Verenigde Staten is bijv. ongeveer 100.000 mensen leven met de ziekte, de meeste van hen Zwart of Latino. Mensen met sikkelcelziekte hebben een kortere levensverwachting en leven gemiddeld pas achter in de veertig, grotendeels als gevolg van beroertes of orgaanschade door geblokkeerde bloedvaten. Esrick, van het Boston Children’s Hospital en de Harvard Medical School, en anderen proberen de ziekte te bestrijden door middel van gentherapie.
Gentherapieën proberen de informatie van het leven te manipuleren door ontbrekende of kapotte genen te vervangen, inactiveren of repareren – en zo patiënten te genezen. Maar de reis naar het handjevol goedgekeurde gentherapieën van vandaag, ook voor ziekten zoals ernstig gecombineerd immunodeficiëntiesyndroom, of SCID, bepaalde bloedkankers en spinale musculaire atrofie, verliep moeizaam. Vroege klinische proeven in de jaren negentig waren niet effectief, en de jaren 2000 hadden onbedoelde en soms dodelijke gevolgen, waaronder een leukemie-achtige ziekte.
Ondanks de uitdagingen van gentherapie, geloven veel onderzoekers dat sikkelcel een goed doelwit is, omdat de moleculaire routes goed worden begrepen en duidelijk zijn. Bovendien hoeft niet elke kopie van het gen gerepareerd te worden om effect te hebben. (Individuen die het gemuteerde gen van slechts één ouder erven, ontwikkelen bijvoorbeeld geen sikkelcelziekte.)
Esrick leidt een klinische proef die een gentherapie test die probeert het lichaam aan te moedigen meer van een gezond type hemoglobine te maken dat wordt geproduceerd door foetussen en jonge baby’s – maar niet door volwassenen – genaamd foetaal hemoglobine. DNA voor het maken van een korte reeks genetisch materiaal, een microRNA genaamd, wordt door een virus in cellen afgeleverd vanuit het beenmerg van een patiënt. Het virus, een vector genaamd, voegt het DNA permanent in de genetische blauwdruk van de cel. Het microRNA interfereert dan met de productie van een eiwit dat de aanmaak van foetaal hemoglobine verhindert. Zodra dat eiwit wordt geblokkeerd, wordt de hemoglobineproductie van de foetus weer ingeschakeld. Net als het opendraaien van een kraan, kan een gestage stroom van de gezonde hemoglobine in de bloedbaan stromen, ter compensatie van de defecte vorm.
Voorlopige gegevens vrijgegeven in januari 2021 toonden aan dat de behandeling hielp zes sikkelcelpatiënten maken foetaal hemoglobinemeldden Esrick en collega’s in de New England Journal of Medicine. Tijdens de follow-upperiode, variërend van enkele maanden tot meer dan twee jaar, werden de symptomen van de patiënten verminderd of geëlimineerd. Het team heeft de proef uitgebreid om meer patiënten op te nemen en de behandeling verder te testen.

Wetenschappers testen ook andere manieren om sikkelcel te bestrijden via gentherapie. Een biotechnologiebedrijf genaamd bluebird bio test een aanpak die een functionele kopie van de HBB gen aan patiënten. Een ander team bereidt zich voor om een proef te starten die dat gen rechtstreeks zal bewerken met behulp van CRISPR/Cas9.
Wetenschapsnieuws stafschrijver Erin Garcia de Jesús sprak met Esrick over het lopende klinische onderzoek naar hemoglobine bij de foetus, inclusief de hindernissen en de hoop. Het gesprek is bewerkt voor lengte en duidelijkheid.
Garcia de Jesús: Welke instrumenten hebben we momenteel om sikkelcelziekte te behandelen?
Esrick: De enige curatieve behandeling is een beenmergtransplantatie. Het beenmerg is als de fabriek voor de bloedcellen. Als je beenmerg kunt krijgen van iemand die geen sikkelcelziekte heeft, dan kun je je eigen gezonde rode bloedcellen laten groeien die geen sikkelcelziekte hebben. Maar dat is een ingrijpende procedure, en het is eigenlijk alleen standaard als je een zogenaamd gematchte broer of zus hebt [a brother or sister without sickle cell whose key white blood cell proteins match yours].
Minder dan 20 procent van de mensen met sikkelcel heeft een gematchte broer of zus beschikbaar. Als er een gematchte broer of zus beschikbaar is, dan is dat een heel goede potentiële behandelingsoptie, maar het is nog steeds een riskante procedure. Het gaat gepaard met enig risico op mortaliteit en veel mogelijke bijwerkingen, zoals graft-versus-host-ziekte en een hoger risico op infectie vanwege immunosuppressiva.
Dan zijn er medicijnen om sikkelcel te behandelen. De meest gevestigde en langdurige wordt hydroxyurea genoemd. Het verhoogt de foetale hemoglobine. Bij veel mensen verhoogt het de foetale hemoglobine aanzienlijk; daarom werkt het zo goed. Het is beschikbaar sinds de jaren ’90 en is geleidelijk aan steeds jongere leeftijden aan het worden.
Nu is het een zeer duidelijke aanbeveling dat in wezen elk kind met sikkelceltherapie erop zou moeten zitten. Maar niet iedereen heeft toegang tot gespecialiseerde hematologische zorg en het is een medicijn dat dagelijks moet worden ingenomen. Sommige mensen hebben bijwerkingen en kunnen er niet tegen. Het werkt ook niet voor iedereen.
Garcia de Jesús: Hoeveel mensen nemen deel aan de proef met uw team en welke resultaten heeft u tot nu toe gezien?
Esrick: Negen patiënten zijn behandeld. We verwachten dat de 10e patiënt binnenkort zal worden behandeld. De voorlopige gegevens van de eerste zes patiënten werden ongeveer een jaar geleden gepubliceerd. Aanvullende gegevens van volgende patiënten waren grotendeels vergelijkbaar – behalve voor één patiënt bij wie de foetale hemoglobinerespons helaas niet zo robuust was.
Garcia de Jesús: Hoe verloopt het proces voor de deelnemers aan het onderzoek?
Esrick: Patiënten moeten hun cellen laten verzamelen [the cells live in the bone marrow and give rise to blood cells], waarvoor een ziekenhuisopname van drie dagen nodig is en soms een paar keer moet worden herhaald. Het is eigenlijk via IV. Daarna worden de cellen naar het lab gebracht.
Wanneer we bericht krijgen van het lab: “OK, we hebben een goed product” [meaning the virus got the DNA into enough cells], dan komt de patiënt terug en wordt voor een maand of zo opgenomen in het ziekenhuis. Het is een lange en zware ziekenhuisopname omdat ze chemotherapie moeten krijgen.
De reden dat ze chemotherapie nodig hebben, is omdat de beenmergcellen die niet zijn verzameld, bijna moeten worden weggevaagd om het voordeel te geven aan de cellen die worden teruggegeven [also through IV] winkel opzetten en produceren.
Chemotherapie brengt veel van de bijwerkingen en risico’s van gentherapie met zich mee, waaronder acute kortetermijnrisico’s zoals gehoorverlies en misselijkheid. En het brengt ook enkele van de langetermijnrisico’s met zich mee, waaronder onvruchtbaarheid en een risico op bloedkanker.
Garcia de Jesús: Waarom kiezen voor gentherapie boven een beenmergtransplantatie als beide chemotherapie vereisen?
Esrick: Met gentherapie is er geen probleem met immunosuppressie, omdat het je eigen cellen zijn. Mensen die een transplantatie van een andere persoon krijgen, moeten gedurende een periode van maanden na de transplantatie immunosuppressieve medicijnen gebruiken. Er bestaat een risico op transplantaatafstoting vanwege de mismatch tussen de donor en de ontvanger.
Het andere risico bij een beenmergtransplantatie van een andere persoon is graft-versus-host-ziekte, waarbij de getransplanteerde en gedoneerde cellen de ontvanger afstoten. Dat kan een ernstige ziekte veroorzaken. Met gentherapie is dat helemaal geen risico.
Garcia de Jesús: Vorig jaar kondigde een klinische proef van een bedrijf genaamd bluebird bio aan dat een proefdeelnemer leukemie kreeg. Kanker is duidelijk een grote zorg en heeft eerdere proeven met gentherapie gedwarsboomd. Wat weten we daar tot nu toe van?
Esrick: Dit was natuurlijk van groot belang voor het veld. Het was eigenlijk het tweede geval van leukemie in die proef. De eerste werd een paar jaar geleden gepubliceerd als een casusrapport.
Als er ooit een geval van leukemie of preleukemie is in een gentherapie-onderzoek, vragen we altijd: werd het veroorzaakt doordat de vector een gen op een gevaarlijke plek plakte?
Het ziet er niet naar uit dat dat het geval is. Bij de eerste patiënt in de bluebird bio-studie die leukemie ontwikkelde, hadden de leukemiecellen niet eens het overgedragen gen in zich. Dus de gedachte was dat dit waarschijnlijk slechts een voorbeeld was van chemotherapie die leukemie veroorzaakt, waarvan we weten dat het kan voorkomen bij een klein percentage van de mensen die chemotherapie krijgen.
Maar het tweede geval, in februari 2021, veroorzaakte echt een rode vlag. Waarom gebeurt dat twee keer in een proef met slechts 40-plussers? Het is nog niet helemaal duidelijk. Er zijn enkele onderzoeken die suggereren dat mensen met sikkelcelziekte een verhoogd risico op leukemie kunnen hebben. Maar de [U.S. Food and Drug Administration] zette de Bluebird-bio-proef in de wacht terwijl er enkele onderzoeken werden gedaan. Toen het vrij duidelijk werd dat het niet direct gerelateerd was aan de vector, mocht de proef heropenen.
Onze studie, die veel overeenkomsten vertoont met de Bluebird-bio-proef, werd niet opgeschort door de FDA, maar werd uitgesteld door onze financier, het National Heart, Lung and Blood Institute terwijl ze naar de gegevens keken. Die greep is onlangs opgeheven.
Garcia de Jesús: Zijn er gevallen van leukemie geweest in het proces van uw team?
Esrick: Gelukkig niet.
Maar weet je, als zoiets in het veld gebeurt, is het een groot probleem. Ik belde alle patiënten die we in onze proef hadden behandeld om hen dat te laten weten. [The bluebird bio cases] gebeurde bij patiënten die drie en vijf jaar eerder waren behandeld. De langst behandelde patiënt in onze studie was bijna drie en een half jaar geleden, en de meest recent behandelde was ongeveer acht of negen maanden geleden. Ik hoop dat we geen zorgwekkende tekenen zien voor een dergelijke nieuwe ontwikkeling, maar het is te vroeg om te zeggen.
Garcia de Jesús: Wat zijn enkele van de grootste uitdagingen die sikkelcel heeft moeten overwinnen?
Esrick: Lange tijd waren er helemaal geen nieuwe therapieën. Deze technologieën hebben lang geduurd omdat ze gebaseerd zijn op fundamentele wetenschappelijke ontdekkingen waaraan werd gewerkt. Maar ook de patiëntenpopulatie met sikkelcel is een populatie die historisch gezien onderbemand is geweest en zonder veel macht.
In de Verenigde Staten zijn het voornamelijk zwarte en latino-patiënten, en over de hele linie hebben die populaties te lijden gehad van ongelijkheid op gezondheidsgebied. Ik denk dat als er een ziekte was geweest die deze mate van morbiditeit en mortaliteit en pijn veroorzaakte in andere delen van de bevolking, het misschien sneller was geweest.
Garcia de Jesús: Wat geeft je hoop? Wat vind je spannend?
Esrick: Ik merk dat ik me achterover buig om ervoor te zorgen dat ik niet overkom als: “We hebben een remedie!” Maar dat gezegd hebbende, het is echt opwindend dat dit een behandeling is die in theorie voor iedereen mogelijk is zonder dat er een [bone marrow] overeenkomst. Dat is een enorm verschil met klassieke beenmergtransplantaties.
De snelheid waarmee nieuwe [gene therapy] behandelingen worden ontwikkeld is verbazingwekkend. Ik denk dat de horizon heel helder is in termen van een of misschien veel van deze therapieën die echt effectief en veilig zijn. Ik heb met zoveel patiënten en families gesproken die contact hebben opgenomen met interesse in onze proef of andere onderzoeken. Er is zo’n enorme onvervulde behoefte. Het feit dat er veel van deze nieuwe behandelingen worden ontwikkeld, is een aanmoediging voor deze families.
