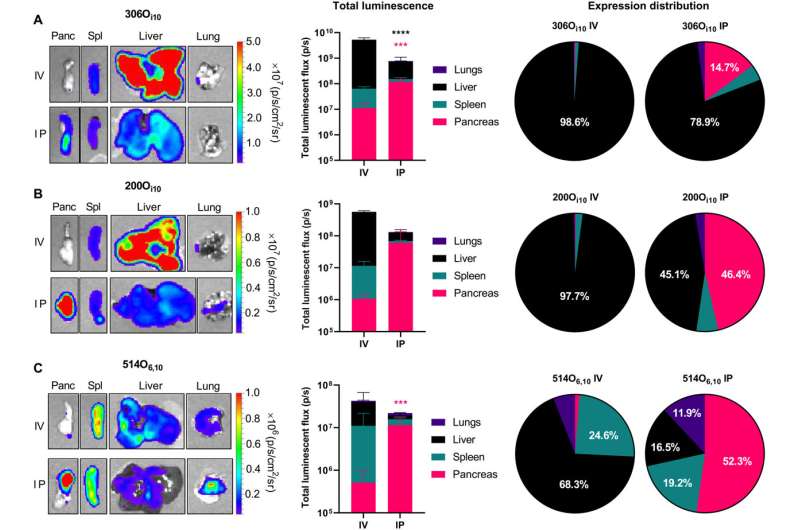
Intraperitoneale toediening verbetert de levering van mRNA aan de pancreas ten opzichte van intraveneuze injectie. LNP’s die mluc bevatten, werden geformuleerd met behulp van elk van de drie ioniseerbare lipidoïden: (A) 306Oi10(B) 200Oi10of (C) 514O6,10—bij een molaire verhouding van 35% lipidoid/16% DOPE/46,5% cholesterol/2,5% PEG-lipid en toegediend aan C57BL/6 muizen (mRNA in een dosis van 0,5 mg/kg) (n = 3 muizen per groep). Drie uur later werden muizen geïnjecteerd met d-luciferine, geëuthanaseerd en ontleed voor ex vivo luminescentiebeeldvorming met behulp van in vivo beeldvormingssysteem (IVIS). De linkerpanelen tonen representatieve IVIS-afbeeldingen van sleutelorganen, de middelste panelen kwantificeren mluc-expressie, de rechterpanelen illustreren het percentage eiwitexpressie dat per orgaan voorkomt. In vergelijking met intraveneuze (IV) toediening verhoogde intraperitoneale (IP) toediening de mRNA-afgifte voor alle formuleringen. Foutbalken vertegenwoordigen SEM. Student’s t-testen werden gebruikt om intraveneuze en intraperitoneale toediening voor elk orgaan te vergelijken. ****P < 0,005 en ****P < 0,001. Credit: Wetenschappelijke vooruitgang (2023). DOI: 10.1126/sciadv.ade1444
Therapeutica die mRNA gebruiken, zoals sommige van de COVID-19-vaccins, hebben een enorm potentieel voor de preventie en behandeling van vele ziekten. Deze therapieën werken door mRNA-“instructies” naar doelcellen te sturen, waardoor ze een blauwdruk krijgen om specifieke eiwitten te maken. Deze eiwitten kunnen weefsels helpen regenereren, slecht functionerende eiwitten vervangen of een immuunrespons opwekken, wat een verscheidenheid aan verschillende behandelingsstrategieën biedt.
Een therapeutisch middel is echter alleen nuttig als het zijn doel kan bereiken. Het mRNA is meestal verpakt in een lipidenanodeeltje, dat de delicate lading intact houdt totdat deze zijn eindbestemming bereikt. Zoals het veld er nu uitziet, bereiken met mRNA gevulde lipidenanodeeltjes over het algemeen slechts een handvol celtypen, zoals immuuncellen en cellen in de lever of milt. Het ontwerpen van dergelijke lipidenanodeeltjes die zich kunnen richten op moeilijk bereikbare organen, zoals het hart of de alvleesklier, zou een revolutie teweeg kunnen brengen in de behandelingsopties voor een breed scala aan aandoeningen.
Als antwoord op deze behoefte ontwikkelen onderzoekers van de Carnegie Mellon University lipide nanodeeltjes die zijn ontworpen om mRNA specifiek naar de pancreas te transporteren. Hun studie bij muizen, onlangs gepubliceerd in Wetenschappelijke vooruitgangzou de weg kunnen banen voor nieuwe therapieën voor hardnekkige pancreasziekten, zoals diabetes en kanker.
“Lipidenanodeeltjes zijn in wezen kleine vetbolletjes, en vetten hebben allerlei chemische eigenschappen die hun vermogen om door het lichaam te reizen en zich op specifieke organen te richten, kunnen beïnvloeden”, legt Luisa Russell, Ph.D., programmadirecteur bij de afdeling Discovery Science & Technology aan het National Institute of Biomedical Imaging and Bioengineering (NIBIB). “Door deze vetmoleculen te optimaliseren en alternatieve medicijnafgifteroutes te onderzoeken, konden de auteurs van het onderzoek een lipidenanodeeltje ontwerpen dat veilig mRNA kan afleveren aan alvleesklierweefsel bij muizen.”
De huidige routes voor het afleveren van mRNA-geneesmiddelen omvatten intramusculaire injectie (gebruikt in COVID-19-vaccins) en intraveneuze toediening (gebruikt in sommige experimentele kankertherapieën). Als eerste stap naar gerichte levering wilden de auteurs van het onderzoek weten of een andere toedieningsroute zou kunnen helpen om de mRNA-lading rechtstreeks naar de alvleesklier te brengen. Ze onderzochten mRNA-afgifte via intraperitoneale injectie, waarbij een medicijn rechtstreeks in de vloeistof wordt geïnjecteerd die de organen van de peritoneale holte omringt (inclusief de nieren, darmen en pancreas).
“Hoewel intraperitoneale injectie bij mensen niet vaak wordt gebruikt, wordt dit type toediening klinisch gebruikt voor sommige moeilijk te behandelen ziekten, zoals eierstokkanker,” zei senior studieauteur Kathryn Whitehead, Ph.D., een professor aan Carnegie Mellon Universiteit. “Bij zeer ernstige alvleesklieraandoeningen wegen de voordelen van intraperitoneale injectie op tegen de risico’s.”
De onderzoekers verpakten mRNA-instructies voor vuurvliegluciferase – een bioluminescent eiwit dat vaak in onderzoek wordt gebruikt – in lipide nanodeeltjes en injecteerden ze vervolgens in muizen, hetzij intraveneus of intraperitoneaal. Met behulp van de gloeiende vuurvliegluciferase om te zien waar het mRNA was gereisd, ontdekten ze dat intraperitoneale injectie resulteerde in een meer overvloedige en specifiekere afgifte aan de pancreas in vergelijking met intraveneuze injectie.
Vervolgens begonnen de onderzoekers de samenstelling van de vetmoleculen waaruit het nanodeeltje bestaat te optimaliseren. Verschillende vetten hebben unieke chemische eigenschappen, zoals grootte, elektrische lading en hydrofobiciteit, die van invloed kunnen zijn op wat er met het nanodeeltje gebeurt zodra het het lichaam binnenkomt. Eén type vetmolecuul dat wordt gebruikt, wordt een “helperlipide” genoemd, zo genoemd omdat het helpt het nanodeeltje te stabiliseren en de potentie ervan verbetert. De onderzoekers wilden weten of het veranderen van de lading van het helperlipide het richten van het nanodeeltje zou kunnen beïnvloeden en het naar de alvleesklier zou kunnen leiden. Na een verscheidenheid aan verschillende samenstellingen van nanodeeltjes te hebben geprobeerd, vonden de onderzoekers een combinatie van lipiden die de pancreastargeting bij muizen verbeterde.
“In de afgelopen paar jaar is er veel meer waardering voor hoe de lipiden in nanodeeltjes mRNA-afgifte naar verschillende cellen en organen kunnen omleiden”, zegt eerste studieauteur Jilian Melamed, Ph.D., een postdoctoraal onderzoeker aan de Universiteit van Pennsylvania. . “De precieze manieren waarop lipidenchemie de potentie en specificiteit van nanodeeltjes beïnvloedt, worden nog steeds ontdekt, en we werken nog steeds aan het begrijpen hoe individuele lipidencomponenten de algehele mRNA-afgifte beïnvloeden.”
Toen de auteurs onderzochten waar hun geoptimaliseerde nanodeeltjes precies in de alvleesklier terechtkwamen, ontdekten ze tot hun verrassing dat mRNA het meest voorkomt in eilandcellen van de alvleesklier, die slechts 1% tot 2% van het totale pancreasweefsel uitmaken. Pancreaseilandcellen zijn verantwoordelijk voor de productie van hormonen die de glucose in het bloed regelen (zoals insuline). Dergelijke specifieke targeting zou potentiële downstream klinische toepassingen kunnen hebben.
“Met verdere ontwikkeling kan ons onderzoek leiden tot het creëren van therapieën voor diabetes of bepaalde vormen van alvleesklierkanker”, aldus Whitehead. “Deze mogelijke behandelingen zouden echter meer preklinisch onderzoek vergen alvorens over te gaan tot klinische proeven.”
Meer informatie:
Jilian R. Melamed et al, Ioniseerbare lipidenanodeeltjes leveren mRNA aan β-cellen van de pancreas via door macrofagen gemedieerde genoverdracht, Wetenschappelijke vooruitgang (2023). DOI: 10.1126/sciadv.ade1444
Tijdschrift informatie:
Wetenschappelijke vooruitgang
Aangeboden door de National Institutes of Health