Het koppelen van ijzeroxide-nanodeeltjes met waterstofperoxide resulteert in een nauwkeurig gerichte behandeling voor het doden van schadelijke orale bacteriën, het afbreken van tandplak en zelfs het diagnosticeren van schadelijke orale biofilms, volgens een nieuwe studie. Krediet: met dank aan de auteurs van het onderzoek
Een groeiend aantal bewijzen wijst op een verband tussen bloedarmoede door ijzertekort en ernstig tandbederf. Of het verband correlatief of oorzakelijk is, is onbekend, hoewel beide aandoeningen worden geassocieerd met slechte voeding en vaker voorkomen bij mensen die in verarmde omgevingen leven en met onderliggende medische aandoeningen.
Nu suggereert onderzoek van de Universiteit van Pennsylvania, in samenwerking met de Universiteit van Indiana, dat een door de FDA goedgekeurde therapie voor bloedarmoede door ijzertekort ook veelbelovend is voor het behandelen, voorkomen en zelfs diagnosticeren van tandbederf. Het therapeutische middel, een combinatie van een ijzeroxide-nanodeeltjesbevattende oplossing genaamd ferumoxytol en waterstofperoxide, werd aangebracht op echt tandglazuur dat in een gebitsprothese werd geplaatst en door de proefpersonen werd gedragen.
De studie, gepubliceerd in het tijdschrift Nano-letters, ontdekte dat een tweemaal daagse toepassing van ferumoxytol, dat waterstofperoxide activeerde in een vervolgspoeling, de opbouw van schadelijke tandplak aanzienlijk verminderde en een gericht effect had op de bacteriën die grotendeels verantwoordelijk zijn voor tandbederf. Deze soorten nanodeeltjes met enzymachtige eigenschappen staan soms bekend als “nanozymen” en worden in toenemende mate onderzocht vanwege hun potentieel in biomedische en milieutoepassingen.
“We ontdekten dat deze aanpak zowel nauwkeurig als effectief is”, zegt Hyun (Michel) Koo, een professor aan de University of Pennsylvania School of Dental Medicine. “Het verstoort biofilms, vooral die gevormd door Streptococcus mutans, die cariës veroorzaken, en het verminderde ook de mate van glazuurverval. Dit is de eerste studie waarvan we weten dat deze in een klinische setting is gedaan en die de therapeutische waarde van nanozymen tegen een infectieziekte aantoont.”
Het werk is een uitbreiding van een artikel uit 2018 gepubliceerd in Natuurcommunicatie, waarin Koo en collega’s, waaronder David Cormode van Penn’s Perelman School of Medicine, aantoonden dat de behandeling met ijzeroxide nanodeeltjes-waterstofperoxide biofilmophoping en tandbederf in een experimenteel model en een diermodel zou kunnen voorkomen.
In het huidige werk wilden de wetenschappers de volgende logische stap zetten, werken in mensen. In een gerandomiseerde studie lieten ze 15 deelnemers een verwijderbaar, kunstgebitachtig apparaat gebruiken waarop echt tandglazuur was bevestigd, een methode die is ontwikkeld en uitgebreid getest door Domenick T. Zero van de Indiana University, een co-corresponderende auteur van het huidige artikel.
De deelnemers aan het onderzoek brachten vier keer per dag een suikerhoudende oplossing op het apparaat aan, waarbij ze suikerrijke maaltijden en snacks nabootsten die in de loop van het dagelijks leven worden geconsumeerd. De deelnemers werd gevraagd de emaille exemplaren niet te poetsen, maar in plaats daarvan het apparaat twee keer per dag te spoelen. De deelnemers werden in drie groepen verdeeld, waarbij één de ferumoxytol gebruikte en vervolgens de waterstofperoxidespoeling, één met een oplossing die de inactieve ingrediënten in ferumoxytol levert en een derde met alleen water.
Na 14 dagen analyseerden de onderzoekers de biofilms die zich op de glazuurmonsters hadden opgehoopt. Ze ontdekten dat de experimentele behandeling de groei van biofilms met S. mutans en zou deze bacterie met hoge specificiteit kunnen doden. Andere commensale bacteriën die normaal in de mond worden aangetroffen, werden niet beïnvloed door de behandeling met ferumoxytol-waterstofperoxide.
De resultaten en veiligheid van de aanpak werden ondersteund door eerder werk, dat heeft aangetoond dat de ijzeroxide-nanodeeltjes niet binden aan het slijmvliesweefsel in de mond en geen cytotoxiciteit of veranderingen in het orale microbioom in een diermodel veroorzaken.
“Deze behandeling lijkt geen schadelijke, off-target effecten te hebben”, zegt Koo.
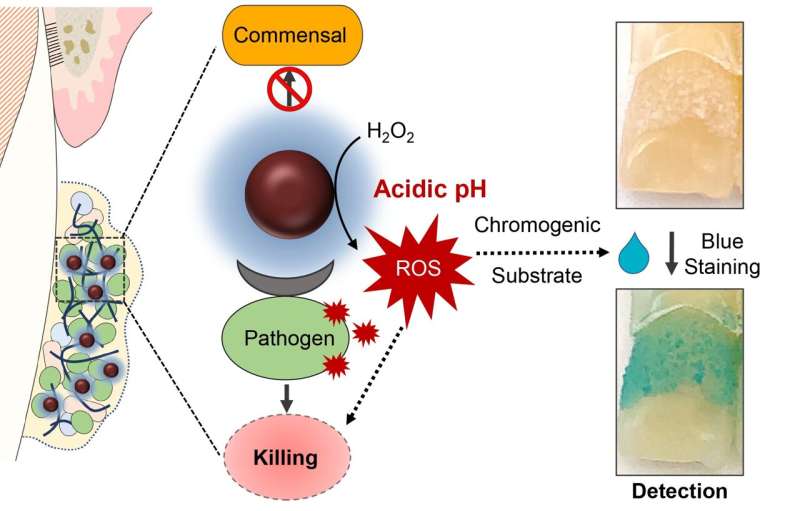
De reden voor deze precisie is drievoudig. De reactie om waterstofperoxide te katalyseren vindt alleen plaats in een zeer zure omgeving, zoals die ontstaat wanneer cariës-veroorzakende bacteriën aanwezig en actief zijn. De behandeling zorgt er ook voor dat de kleverige matrix van koolhydraten afbreekt, de biofilm afbreekt en de microben blootstelt. En ferumoxytol kan specifiek binden aan receptoren op de S. mutans celmembraan, waardoor het doden ervan wordt vergemakkelijkt.
In een laatste fase van het onderzoek voegden de onderzoekers een marker toe die blauw wordt bij blootstelling aan reactieve zuurstofsoorten, zoals die gegenereerd door de katalyse van waterstofperoxide door ferumoxytol-nanodeeltjes. En inderdaad, het team ontdekte dat de intensiteit van blauwe etikettering overeenkwam met zure biofilms die S. mutans.
Vanwege dit “detectievermogen”, merkt Koo op dat de experimentele behandeling het potentieel heeft om te worden wat bekend staat als een “theranostic”, dat wil zeggen een medicijn dat kan worden gebruikt om zowel een aandoening te diagnosticeren als te behandelen. “Het kan ook thuis worden gebruikt”, zegt Koo. “Je zou ermee kunnen spoelen, kijken hoeveel gaatjes veroorzakende tandplak er is, en dan behandelen met de oplossing of een tandarts raadplegen voor een vervolgbehandeling.”
Yuan Liu et al, Ferumoxytol-nanodeeltjes richten zich op biofilms die tandbederf in de menselijke mond veroorzaken, Nano-letters (2021). DOI: 10.1021/acs.nanolet.1c02702
Nano-letters
,
Natuurcommunicatie
Geleverd door de Universiteit van Pennsylvania