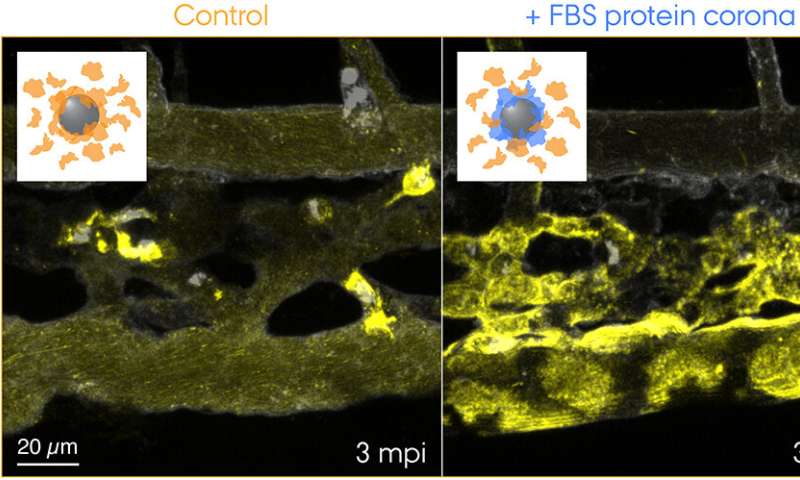
Fluorescent gelabelde 70 nm SiO2-nanodeeltjes werden geïnjecteerd in de bloedbaan van 3 dagen oude transgene zebravisembryo’s en 3 minuten na de injectie live afgebeeld. De inzetstukken tonen schema’s voor de twee geteste condities: controle-nanodeeltjes met een corona van endogene eiwitten (oranje) en nanodeeltjes met een voorgevormde corona van foetaal runderserum (FBS) -eiwitten (blauw) en aanvullende endogene eiwitten. Controle-nanodeeltjes worden snel opgevangen door macrofagen, terwijl de nanodeeltjes met een niet-zelfbiologische identiteit effectief worden gesekwestreerd door scavenger-endotheelcellen. Krediet: Yuya Hayashi. Aangepast van Mohammad-Beigi et al. (2020) ACS Nano. Auteursrecht 2020 American Chemical Society
Een verscheidenheid aan nanodeeltjes is ontworpen voor gerichte medicijnafgifte, maar helaas bereikt slechts een zeer klein deel van de geïnjecteerde nanodeeltjes de doellocatie, zoals vaste tumoren. De reden achter de lage doelgerichtheid wordt vaak als een “zwarte doos” beschouwd en is daarom jarenlang weinig onderzocht.
Onlangs heeft een internationaal onderzoeksteam onder leiding van Yuya Hayashi van de Afdeling Moleculaire Biologie en Genetica (MBG), Universiteit van Aarhus, de schoonheid aangetoond van zebravisembryo’s in nano-bioimaging die dynamische interacties tussen nanodeeltjes en interessante cellen in een levend organisme kunnen visualiseren. (zie een ander artikel “Zebravissen laten je het biologische lot van nanodeeltjes in vivo zien”).
Nu, in samenwerking met onderzoekers van het Interdisciplinair Nanoscience Center (iNANO), probeert Yuya onopgeloste mysteries in de bionanowetenschap te beantwoorden – de eerste in de rij is het biologische identiteitsconcept, dat uitlegt hoe cellen nanodeeltjes herkennen via een “corona” van eiwitten die elk deeltje omringen. . Dit concept is nu voor het eerst bewezen in een levend organisme door het gebruik van zebravisembryo’s die blootleggen wat er gebeurt met nanodeeltjes die in het bloed worden geïnjecteerd.
Vriend of vijand? Hoe biologische systemen nanodeeltjes herkennen
“What the Cell Sees in Bionanoscience” is een van de vroege publicaties die hebben gedefinieerd hoe een corona van eiwitten wordt gevormd rond een nanodeeltje en hoe zo’n eiwitcorona de noodzaak inhoudt om de manier waarop we naar nanodeeltjes kijken in een biologisch milieu te heroverwegen. Uit uitgebreid onderzoek in het afgelopen decennium begrijpen we nu dat twee tegengestelde effecten voornamelijk bijdragen aan de opname van nanodeeltjes door cellen. Over het algemeen verhindert de eiwitcorona dat het oppervlak van nanodeeltjes directe fysieke interacties met het celmembraan heeft. Maar wat als de eiwitcorona een signaal vertoont dat een specifieke biologische interactie teweegbrengt met receptoren die op het celmembraan worden ingezet? Dat is iets wat de cel ziet en geeft zo een biologische identiteit aan het nanodeeltje.
Nu hebben de onderzoekers van de Universiteit van Aarhus dus het eerste “visuele” bewijs geleverd voor de opvallende bijdrage van de eiwitcorona aan de verwijdering van nanodeeltjes uit het bloed, wat tot nadelige resultaten leidde in het zebravisembryomodel. Het onderzoeksteam gebruikte een soort-niet-overeenkomende bron van eiwitten voor de coronavorming om een ’niet-zelf’-biologische identiteit te creëren en volgde de reis van nanodeeltjes die door het bloed reisden en naar hun eindbestemming – endolysosomen in de cel. Dit onthulde een verrassend snelle opname en verzuring van de nanodeeltjes door scavenger-endotheelcellen (functioneel equivalent aan de lever-sinusoïdale endotheelcellen bij zoogdieren), gevolgd door pro-inflammatoire activering van macrofagen (zie de film op de webpagina van de groep van Yuya).
“Het klinkt als een gek idee om nanodeeltjes te injecteren met eiwitten van een ander dier”, zegt Yuya, “maar op biomoleculen geïnspireerde nanomedicijnen worden bijvoorbeeld getest in een muismodel zonder bijzondere zorgen te maken over de soort-niet-overeenkomende combinatie. Of anders een paar slimme mensen. de muis vermenselijken om het soortcompatibiliteitsprobleem op te lossen. In feite worden nanodeeltjes zelfs op celkweekniveau nog steeds routinematig getest volgens de traditie om serumsupplementen te gebruiken die afkomstig zijn van koeien, terwijl we weten dat nanodeeltjes-eiwitinteracties een belangrijke motor zijn voor cellulaire opname . “
“Wat dit soort experimenten nogal uitdagend maakt, is”, voegt eerste auteur Hossein Mohammad-Beigi eraan toe, “om de oorspronkelijke eiwitcorona maximaal te behouden in een levend organisme. Als de voorgevormde corona snel wordt uitgewisseld door endogene bloedeiwitten, is de hypothese getest wordt ongeldig. We hebben heel wat inspanningen geleverd om de eiwitcorona te karakteriseren om ervoor te zorgen dat de nanodeeltjes de niet-zelfbiologische identiteit behouden. “
Zien is geloven – het zebravismodel kan bieden wat knaagdiermodellen niet kunnen
Het grootste voordeel van het zebravismodel is zijn kracht in real-time beeldvorming in meerdere kleuren, waarbij meerdere combinaties van fluorescentietracers en reportereiwitten kunnen worden afgebeeld in een eenvoudige opstelling met een hoge spatio-temporele resolutie. Dit biedt een nieuwe kans die ligt tussen minder realistische celkweeksystemen en meer uitdagende knaagdierexperimenten zoals intravitale microscopie.
“Met behulp van celculturen hebben we veel geleerd over hoe cellen nanodeeltjes herkennen als dynamische aggregaten van eiwitten, maar het is nooit getest in een realistischere situatie”, legt Yuya uit. “Met de oprichting van het zebravismodel hebben we eindelijk een middel verworven om deze vraag verder te onderzoeken in een levend organisme. Het was een eenvoudige aanpak met een extreem scenario getest in een zeer complex systeem, maar ik denk dat we nu een stap dichterbij zijn begrijpen wat de eiwitcorona echt kan betekenen voor nanodeeltjes. In een omgeving die rijk is aan eiwitten, kunnen nanodeeltjes een masker dragen dat ze een biologische identiteit geeft, en door hun niet-zelfheid kunnen ze een vijand worden. Wat bepaalt de mate van niet-zelfheid ‘Nou, het is de volgende grote vraag die we moeten beantwoorden.’
Hossein Mohammad-Beigi et al, Tracing the In Vivo Fate of Nanoparticles with a “Non-Self” Biological Identity, ACS Nano (2020). DOI: 10.1021 / acsnano.0c05178
ACS Nano
Geleverd door Aarhus University