Door licht geactiveerde eiwitten die in oogzenuwcellen worden ingebracht en een speciale bril helpen hem objecten te zien

Een soort gentherapie en een speciale bril hielpen een blinde man sommige voorwerpen weer te zien. Een elektro-encefalogram (rood) op het hoofd van de man toonde aan dat signalen van zijn behandelde oog het visuele centrum van de hersenen bereikten.
Een nieuw type gentherapie waarbij zenuwcellen opnieuw in het oog worden aangebracht, heeft een blinde man een beperkt zicht gegeven.
De 58-jarige man heeft een genetische ziekte genaamd retinitis pigmentosa, die ervoor zorgt dat lichtverzamelende cellen in het netvlies afsterven. Vóór de behandeling, bekend als optogenetische therapie, kon de man wat licht detecteren, maar geen beweging zien of objecten uitkiezen. Nu kan hij objecten zien en tellen en meldden zelfs dat ze de witte strepen van een voetgangersoversteekplaats konden zien, rapporteren onderzoekers 24 mei in Nature Medicine. Zijn zicht is nog steeds beperkt en vereist dat hij een speciale bril draagt die lichtpulsen naar het behandelde oog stuurt.
‘Het is spannend. Het is echt goed om te zien dat het werkt en dat het een aantal duidelijke reacties krijgt van patiënten ”, zegt David Birch, expert op het gebied van retinale degeneratie bij de Retina Foundation of the Southwest in Dallas. Birch heeft klinische proeven gedaan met andere optogenetische therapieën, maar was niet betrokken bij deze studie.
Onderzoekers werken al meer dan een decennium aan optogenetische therapieën om het gezichtsvermogen te herstellen bij mensen met degeneratieve oogaandoeningen, zoals retinitis pigmentosa (SN: 15-05-15). De therapie omvat het gebruik van een lichtgevoelig eiwit om zenuwcellen een signaal naar de hersenen te laten afvuren wanneer ze worden geraakt met een bepaalde golflengte van licht.
Optogenetische therapie is anders dan traditionele gentherapie, die een defecte versie van een gen vervangt door een gezonde versie. Het verschilt ook van genbewerking, waarbij moleculaire tools zoals CRISPR / Cas9 worden gebruikt om ziekteverwekkende varianten in bepaalde genen te repareren. In 2017 heeft de Amerikaanse Food and Drug Administration keurde een traditionele gentherapie goed dat een zeldzame vorm van erfelijke blindheid behandelt die wordt veroorzaakt door mutaties in de RPE65 gen. En andere onderzoekers doen klinische proeven met genbewerking om een bepaalde mutatie te corrigeren die een erfelijke vorm van blindheid veroorzaakt, genaamd Leber congenitale amaurosis 10 (SN: 14-08-19).
Die therapieën kunnen de progressie van degeneratieve oogziekten stoppen of vertragen, maar helpen mensen die al het gezichtsvermogen hebben verloren niet, zegt Botond Roska, een neurowetenschapper en gentherapeut aan het Instituut voor Moleculaire en Klinische Oogheelkunde Basel en de Universiteit van Basel in Zwitserland. Gentherapie en genbewerking richten zich ook alleen op bepaalde genen, maar retinitis pigmentosa kan worden veroorzaakt door veranderingen in een van de meer dan 50 genen. Optogenetische therapie kan mensen helpen die door veel ziekten hun gezichtsvermogen hebben verloren, ongeacht de genveranderingen die ze veroorzaken. Dergelijke ziekten omvatten mogelijk maculaire degeneratie, die wereldwijd miljoenen mensen treft.
Eerdere versies van optogenetische therapie gebruikten een eiwit genaamd channelrhodopsin-2 uit algen om zenuwcellen te laten reageren op licht. Dat eiwit heeft veel helder blauw licht nodig om het te laten werken. “Het is alsof je naar de zon in de woestijn staart”, zegt José-Alain Sahel, oogarts en retinaspecialist aan de Universiteit van Pittsburgh en de Sorbonne Universiteit in Parijs. Het lichtniveau dat nodig is om het eiwit aan te zetten, kan alle resterende cellen in het netvlies doden. Dus ontwikkelden Sahel, Roska en collega’s hun therapie met een ander lichtgevoelig eiwit dat reageert op amberkleurig licht, dat minder schade toebrengt aan cellen dan blauwe of groene golflengten.
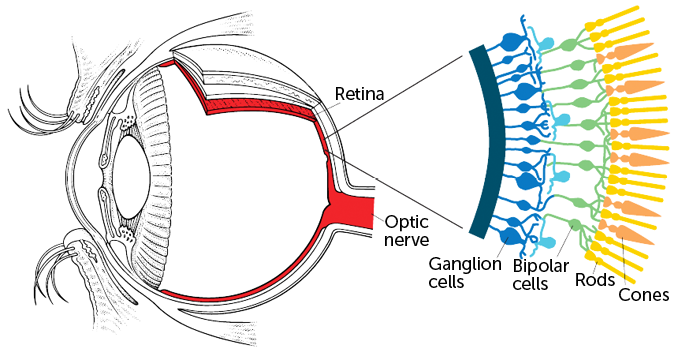
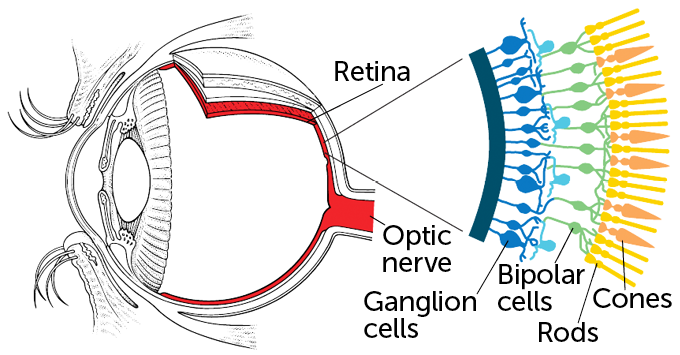
Het team gebruikte een virus dat adeno-geassocieerd virus wordt genoemd om instructies te geven voor het maken van het eiwit aan bepaalde cellen in de ogen van de man. Het team koos ervoor om de instructies in te voegen in een laag zenuwcellen die ganglioncellen worden genoemd.
Het netvlies heeft drie lagen: lichtverzamelende staafjes en kegeltjes bevinden zich aan de achterkant van het netvlies. Die fotoreceptorcellen zijn de eersten die sterven bij de degeneratieve ziekte. Vervolgens komt een laag zenuwcellen die bekend staan als bipolaire cellen. Ze verwerken visuele informatie en geven signalen door aan ganglioncellen in de derde laag. De ganglioncellen sturen berichten naar visuele centra in de hersenen.
Sommige onderzoekers, waaronder het team van Sahel en Roska, experimenteren ook met het inbrengen van optogenetische eiwitten in bipolaire cellen, slapende kegeltjes (die hun functie hebben verloren maar niet zijn gestorven) of andere zenuwcellen. Maar ganglioncellen waren het gemakkelijkste doelwit, zegt Roska. Ze kunnen worden bereikt door het virus eenvoudig in het midden van het oog te injecteren. En ganglioncellen blijven hangen lang nadat staafjes, kegeltjes en bipolaire cellen zijn gestorven.
De Fransman kan nog steeds niet zien zonder een speciale bril die pulsen van amberkleurig licht naar zijn oog stuurt. Dat komt omdat ganglioncellen meestal reageren op veranderingen in licht. Als het licht constant is, blijven ze niet vuren, dus pulsen zijn nodig, zegt Roska.
Bovendien, terwijl normaal zicht kan werken bij weinig sterrenlicht tot de zonnigste dag op het strand, hebben de optogenetische eiwitten een zeer beperkt bereik van lichtniveaus waaronder ze kunnen werken, zegt Zhuo-Hua Pan, een vision-neurowetenschapper aan de Wayne State University in Detroit was niet betrokken bij het onderzoek. De bril maakt gebruik van digitale cameratechnologie om de lichtniveaus automatisch aan te passen en naar het oog van de man te sturen. Mensen die optogenetische therapie krijgen, moeten misschien allemaal een veiligheidsbril dragen om visuele informatie te helpen verwerken voordat deze naar de hersenen gaat, zeggen Pan en Birch.
Met de bril die lichtpulsen naar zijn behandelde oog stuurde, kon de man voorwerpen zoals een boek, kopjes en een fles handdesinfecterend middel op een tafel zien en herkennen.
De onderzoekers tonen aan dat de bril nodig is om de man de objecten te laten zien. Om echt te laten zien dat de therapie werkte, zouden de onderzoekers moeten zien of het amberkleurige licht in zijn oog schijnt voordat de therapie zou genoeg kunnen zijn om hem te laten zien, zegt Sheila Nirenberg, een neurowetenschapper bij Weill Cornell Medicine in New York City en oprichter van Bionic Sight, een bedrijf dat ook optogenetica gebruikt om blindheid te behandelen. Als dat zo is, zou dat erop wijzen dat alleen helder licht, en niet de therapie zelf, achter de verandering van het gezichtsvermogen zit.
Haar bedrijf rapporteerde in een persbericht in maart dat blinde mensen in de klinische proef licht en beweging konden zien na behandeling. De resultaten zijn voorlopig. Een volledig rapport van de klinische proef kan een jaar of langer duren, zegt Nirenberg.
Een ander bedrijf, Nanoscope Technologies in Bedford, Texas, zei in een presentatie op een virtuele bijeenkomst van de American Academy of Ophthalmology in november dat het ook hersteld beperkt zicht bij sommige mensen met retinitis pigmentosa. Maar een volledige boekhouding van de gegevens is niet vrijgegeven. “Zonder de details is het moeilijk te beoordelen”, zegt Pan.
De Nature Medicine Het rapport is bemoedigend omdat het enkele van die details laat zien, hoewel Pan zegt dat hij meer wil weten over wat de patiënt buiten het laboratorium kan zien. Toch zegt hij blij te zijn dat het werk eindelijk resultaten oplevert. “We wachten al jaren om dit te horen.”
Sahel en Roska benadrukken dat de therapie geen remedie is tegen blindheid. “Voorlopig kunnen we alleen maar zeggen dat er één patiënt is … met een functioneel verschil”, zegt Roska. Sahel voegt eraan toe: “Het is een mijlpaal op weg naar nog betere resultaten.”